用于制备聚烯烃的氨基-j9九游会真人
用于制备聚烯烃的氨基-苯并咪唑催化剂
1.交叉引用
2.本技术要求于2021年2月26日提交的美国临时专利申请序列号63/153,980的权益,该美国临时专利申请据此全文以引用方式并入。
技术领域
3.本公开的实施方案总体上涉及烯烃聚合催化剂体系和方法,并且更具体地涉及氨基-苯并咪唑催化剂。
背景技术:
4.通过各种催化剂体系产生了诸如聚乙烯、基于乙烯的聚合物、聚丙烯和基于丙烯的聚合物等基于烯烃的聚合物。在基于烯烃的聚合物的聚合方法中使用的此类催化剂体系的选择是有助于此类基于烯烃的聚合物的特性和性质的重要因素。
5.基于乙烯的聚合物和基于丙烯的聚合物被制造用于各种制品。聚乙烯和聚丙烯聚合方法可以在许多方面上有所不同,以产生具有不同物理特性的各种所得聚乙烯树脂,这些不同物理特性使各种树脂适于用于不同的应用。乙烯单体以及任选地一种或多种共聚单体存在于液体稀释剂(诸如溶剂)中,诸如烷烃或异烷烃,例如异丁烯。也可以将氢气添加到反应器中。用于产生基于乙烯的催化剂体系通常可以包括基于铬的催化剂体系、齐格勒-纳塔(ziegler
–
natta)催化剂体系和/或分子(茂金属或非茂金属(分子))催化剂体系。稀释剂和催化剂体系中的反应物在升高的聚合温度下在反应器周围循环,从而产生基于乙烯的均聚物或共聚物。周期性地或连续地从反应器中去除包含溶解在稀释剂中的聚乙烯产物的反应混合物的一部分以及未反应的乙烯和一种或多种任选的共聚单体。反应混合物当从反应器中去除时可以被加工以从稀释剂和未反应的反应物中去除聚乙烯产物,其中稀释剂和未反应的反应物通常被再循环回到反应器中。另选地,可以将反应混合物送到与第一反应器串联连接的第二反应器,在第二反应器中,可以产生第二聚乙烯级分。尽管研究致力于开发适于诸如聚乙烯或聚丙烯聚合等烯烃聚合的催化剂体系,但是仍然需要提高能够产生具有高分子量和窄分子量分布的聚合物的催化剂体系的效率。
技术实现要素:
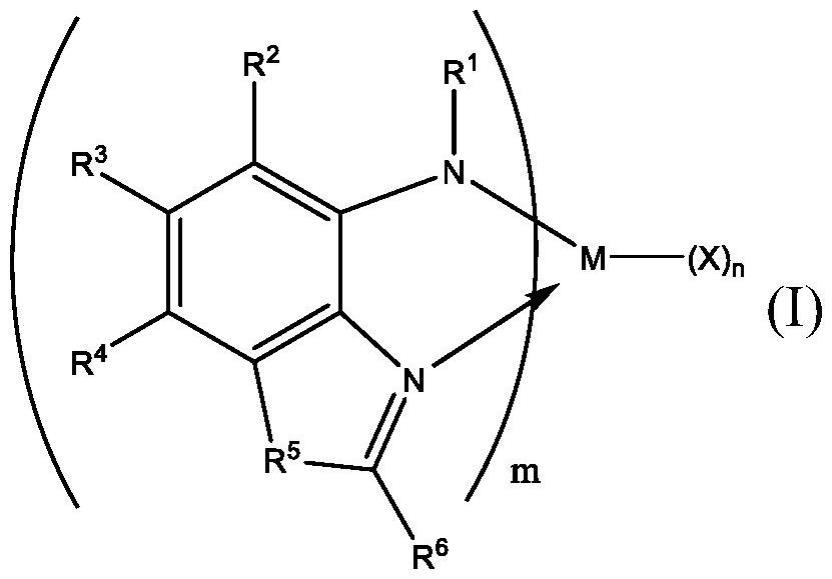
6.1.一种催化剂体系,所述催化剂体系包含根据式(i)的金属-配体络合物:
[0007][0008]
在式(i)中,m为选自钛、锆或铪的金属,所述金属具有 2、 3或 4的形式氧化态;每个x是独立地选自不饱和(c
2-c
50
)烃、不饱和(c
2-c
50
)杂烃、(c
1-c
50
)烃基、(c
6-c
50
)芳基、(c
6-c
50
)杂芳基、环戊二烯基、经取代的环戊二烯基、(c
4-c
12
)二烯、卤素和-ch2sir
c3
的单齿或二齿配体;其中每个rc选自由以下项组成的组:(c
1-c
30
)烃基或
–
h。(x)n的下标n为2或3;并且下标m为1或2。所述式(i)的金属-配体络合物具有6个或更少的金属-配体键。
[0009]
在式(i)中,每个r1独立地选自由以下项组成的组:经取代的(c
1-c
50
)烷基、未经取代的(c
1-c
50
)烷基、经取代的(c
6-c
50
)芳基和未经取代的(c
6-c
50
)芳基。每个r2、r3和r4独立地选自
–
h、(c
1-c
50
)烃基、(c
1-c
50
)杂烃基、(c
6-c
50
)芳基、(c
4-c
50
)杂芳基、卤素原子、-orc、-si(rc)3和-ge(rc)3;并且每个r5选自s、-nrn或cr
n2
,其中每个rn为(c
1-c
20
)烃基或-h;并且每个r6独立地选自
–
h、(c
1-c
50
)烃基、(c
1-c
50
)杂烃基、(c
6-c
50
)芳基、(c
4-c
50
)杂芳基、-si(rc)3和-ge(rc)3。
具体实施方式
[0010]
现在将描述催化剂体系的具体实施方案。应当理解,本公开的催化剂体系可以不同的形式体现,并且不应被解释为限于本公开所阐述的具体实施方案。
[0011]
下文列出了常见的缩写:
[0012]
r、z、m、x和n:如上文所定义;me:甲基;et:乙基;ph:苯基;bn:苄基;i-pr:异丙基;t-bu:叔丁基;t-oct:叔辛基(2,4,4-三甲基戊烷-2-基);tf:三氟甲烷磺酸盐;cv:柱体积(柱层析中使用);etoac:乙酸乙酯;tea:三乙基铝;mao:甲基铝氧烷;mmao:改性的甲基铝氧烷;lich2tms:(三甲基甲硅烷基)甲基锂;tms:三甲基甲硅烷基;pd(amphos)cl2:双(二叔丁基(4-二甲基氨基苯基)膦)二氯化钯(ii);pd(amphos):氯(巴豆基)(二叔丁基(4-二甲基氨基苯基)膦)钯(ii);pd(dppf)cl2:[1,1'-双(二苯基膦基)二茂铁]二氯化钯(ii);sccl3:氯化钪(iii);phme:甲苯;thf:四氢呋喃;ch2cl2:二氯甲烷;dmf:n,n-二甲基甲酰胺;etoac:乙酸乙酯;et2o:乙醚;meoh:甲醇;nh4cl:氯化铵;mgso4:硫酸镁;na2so4:硫酸钠;naoh:氢氧化钠;brine:饱和氯化钠水溶液;sio2:二氧化硅;cdcl3:氯仿-d;gc:气相色谱;lc:液相色谱;nmr:核磁共振;ms:质谱;mmol:毫摩尔;ml:毫升;m:摩尔;min或mins:分钟;h或hrs:小时;d:天;tlc:薄层色谱;rpm:每分钟转数;rt:室温。
[0013]
术语“独立地选自”在本文中用于指示,如r1、r2、r3、r4和r5等r基团可以相同或不同(例如,r1、r2、r3、r4和r5均可以是经取代的烷基,或者r1和r2可以是经取代的烷基,并且r3可以是芳基等)。与r基团相关的化学名称旨在传达如与化学名称的化学结构相对应的在本领域中公认的化学结构。因此,化学名称旨在补充和说明而不是排除本领域技术人员已知的
结构定义。
[0014]
当用于描述某些含碳原子的化学基团时,形式为“(c
x-cy)”的插入语表达意指该化学基团的未经取代的形式具有x个碳原子到y个碳原子(包含x和y)。例如,(c
1-c
50
)烷基为其未经取代的形式中具有1到50个碳原子的烷基基团。在一些实施方案和一般结构中,某些化学基团可以被如rs等一个或多个取代基取代。使用插入语“(c
x-cy)”定义的被rs取代的化学基团可以含有多于y个碳原子,这取决于任何基团rs的特性。例如,“恰好被一个基团rs取代的(c
1-c
50
)烷基,其中rs为苯基(-c6h5)”可含有7到56个碳原子。因此,通常,当使用插入语“(c
x-cy)”定义的化学基团被一个或多个含碳原子的取代基rs取代时,通过将x和y两者加上来自所有含碳原子的取代基rs的碳原子数的组合总和来确定化学基团的最小和最大碳原子总数。
[0015]
术语“取代”意指与对应的未经取代的化合物或官能团的碳原子或杂原子键合的至少一个氢原子(-h)被取代基(例如rs)替换。术语“全取代”意指与对应的未被取代的化合物或官能团的碳原子或杂原子键合的每个氢原子(h)被取代基(例如,rs)替换。术语“多取代”意指与对应的未被取代的化合物或官能团的碳原子或杂原子键合的至少两个但少于所有氢原子被取代基替换。术语
“‑
h”意指与另一个原子共价键合的氢或氢基团。“氢”和
“‑
h”是可互换的,并且除非明确规定,否则具有相同的含义。
[0016]
术语“(c
1-c
50
)烃基”意指具有1到50个碳原子的烃基团,并且术语“(c
1-c
50
)亚烃基”意指具有1到50个碳原子的烃双基团,其中每个烃基团和每个烃双基团是芳香族或非芳香族的、饱和或不饱和的、直链或支链的、环状(具有三个碳或更多个碳,并且包括单环和多环、稠合和非稠合多环和双环)或非环状的,以及被一个或多个rs取代或未取代的。
[0017]
在本公开中,(c
1-c
50
)烃基可以是未经取代或经取代的(c
1-c
50
)烷基、(c
3-c
50
)环烷基、(c
3-c
20
)环烷基-(c
1-c
20
)亚烷基、(c
6-c
40
)芳基或(c
6-c
20
)芳基-(c
1-c
20
)亚烷基(诸如苄基(-ch
2-c6h5))。
[0018]
术语“(c
1-c
50
)烷基”和“(c
1-c
18
)烷基”分别意指未被取代的或被一个或多个rs取代的具有1到50个碳原子的饱和直链或支链烃基团和具有1到18个碳原子的饱和直链或支链烃基团。未经取代的(c
1-c
50
)烷基的示例为未经取代的(c
1-c
20
)烷基;未经取代的(c
1-c
10
)烷基;未经取代的(c
1-c5)烷基;甲基;乙基;1-丙基;2-丙基;1-丁基;2-丁基;2-甲基丙基;1,1-二甲基乙基;1-戊基;1-己基;1-庚基;1-壬基;和1-癸基。取代的(c
1-c
40
)烷基的示例为取代的(c
1-c
20
)烷基、取代的(c
1-c
10
)烷基、三氟甲基和[c
45
]烷基。术语“[c
45
]烷基”意指基团(包括取代基)中存在最多45个碳原子,并且是例如(c
27-c
40
)烷基,其分别被一个rs(其为(c
1-c5)烷基)取代。每个(c
1-c5)烷基可以是甲基、三氟甲基、乙基、1-丙基、1-甲基乙基或1,1-二甲基乙基。
[0019]
术语“(c
6-c
50
)芳基”意指具有6到40个碳原子的未被取代的或被(一个或多个rs)取代的单环、双环或三环芳香族烃基团,其中至少6到14个碳原子是芳香族环碳原子。单环芳香族烃基团包括一个芳香族环;双环芳香族烃基团具有两个环;并且三环芳香族烃基团具有三个环。当双环或三环芳香族烃基团存在时,该基团的环中的至少一个环是芳香族的。芳香族基团的其他一个或多个环可以独立地是稠合的或非稠合的并且是芳香族的或非芳香族的。未经取代的(c
6-c
50
)芳基的示例包括:未经取代的(c
6-c
20
)芳基、未经取代的(c
6-c
18
)芳基;2-(c
1-c5)烷基-苯基;苯基;芴基;四氢芴基;二环戊二烯并苯基;六氢二环戊二烯
并苯基;茚基;二氢茚基;萘基;四氢萘基;和菲。经取代的(c
6-c
40
)芳基的示例包括:经取代的(c
1-c
20
)芳基;经取代的(c
6-c
18
)芳基;2,4-双([c
20
]烷基)-苯基;聚氟苯基;五氟苯基;和芴-9-酮-1-基。
[0020]
术语“(c
3-c
50
)环烷基”意指具有3到50个碳原子的饱和环状烃基团,其未被取代或被一个或多个rs取代。其他环烷基(例如,(c
x-cy)环烷基)以类似的方式被定义为具有x到y个碳原子,并且是未经取代的或被一个或多个rs取代的。未经取代的(c
3-c
40
)环烷基的示例是未经取代的(c
3-c
20
)环烷基、未经取代的(c
3-c
10
)环烷基、环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基和环癸基。经取代的(c
3-c
40
)环烷基的示例是经取代的(c
3-c
20
)环烷基、经取代的(c
3-c
10
)环烷基、环戊酮-2-基和1-氟环己基。
[0021]
(c
1-c
50
)亚烃基的示例包括未经取代的或经取代的(c
6-c
50
)亚芳基、(c
3-c
50
)亚环烷基和(c
1-c
50
)亚烷基(例如,(c
1-c
20
)亚烷基)。双基团可以在同一个碳原子(例如,-ch
2-)上或在相邻碳原子(即,1,2-双基团)上,或者间隔开一个、两个或多于两个中间碳原子(例如,1,3-双基团、1,4-双基团等)。一些双基团包括1,2-双基团、1,3-双基团、1,4-双基团或α,ω-双基团和其他1,2-双基团。α,ω-二基是在基团碳之间具有最大碳主链间距的二基。(c
2-c
20
)亚烷基α,ω-双基团的一些示例包括乙-1,2-二基(即,-ch2ch
2-)、丙-1,3-二基(即,-ch2ch2ch
2-)、2-甲基丙-1,3-二基(即,-ch2ch(ch3)ch
2-)。(c
6-c
50
)亚芳基α,ω-双基团的一些示例包括苯基-1,4-二基、萘-2,6-二基或萘-3,7-二基。
[0022]
术语“(c
1-c
50
)亚烷基”意指具有1到50个碳原子的未经取代的或被一个或多个rs取代的饱和直链或支链双基团(即,基团不在环原子上)。未经取代的(c
1-c
50
)亚烷基的示例是未经取代的(c
1-c
20
)亚烷基,包括未经取代的-ch2ch
2-、-(ch2)
3-、-(ch2)
4-、-(ch2)
5-、-(ch2)
6-、-(ch2)
7-、-(ch2)
8-、-ch2c*hch3和-(ch2)4c*(h)(ch3),其中“c*”表示从其中去除氢原子以形成仲烷基或叔烷基基团的碳原子。经取代的(c
1-c
50
)亚烷基的示例是经取代的(c
1-c
20
)亚烷基、-cf
2-、-c(o)-和-(ch2)
14
c(ch3)2(ch2)
5-(即,6,6-二甲基取代的正-1,20-二十碳烯)。由于如前所述,两个rs可以一起形成(c
1-c
18
)亚烷基,经取代的(c
1-c
50
)亚烷基的示例还包括1,2-双(亚甲基)环戊烷、1,2-双(亚甲基)环己烷、2,3-双(亚甲基)-7,7-二甲基-二环[2.2.1]庚烷和2,3-双(亚甲基)二环[2.2.2]辛烯。
[0023]
术语“(c
3-c
50
)亚环烷基”意指具有3到50个碳原子的未被取代的或被一个或多个rs取代的环状双自由基(即,自由基在环原子上)。
[0024]
术语“杂原子”是指除氢或碳之外的原子。含有一个或多于一个杂原子的基团的示例包括o、s、s(o)、s(o)2、si(rc)2、p(r
p
)、n(rn)、-n=c(rc)2、-ge(rc)
2-、-si(rc)-、硼(b)、铝(al)、镓(ga)或铟(in),其中每个rc和每个r
p
是未经取代的(c
1-c
18
)烃基或-h,并且其中每个rn是未经取代的(c
1-c
18
)烃基。术语“杂烃”是指烃的一个或多个碳原子被杂原子替换的分子或分子骨架。术语“(c
1-c
50
)杂烃基”意指具有1个至50个碳原子的杂烃基团,并且术语“(c
1-c
50
)杂亚烃基”意指具有1到50个碳原子的杂烃双基团。t(c
1-c
50
)杂烃基或(c
1-c
50
)亚杂烃基的杂烃具有一个或多个杂原子。杂烃基的基团可以在碳原子或杂原子上。杂亚烃基的两个基团可以在单个碳原子上或在单个杂原子上。另外,双基团的两个基团中的一个基团可以在碳原子上,并且另一个基团可以在不同的碳原子上;两个基团中的一个基团可以在碳原子上,并且另一个基团在杂原子上;或两个基团中的一个基团可以在杂原子上,并且另一个基团在不同的杂原子上。每个(c
1-c
50
)杂烃基和(c
1-c
50
)杂亚烃基可以是未经取代的
或被(一个或多个rs)取代的、芳香族或非芳香族的、饱和或不饱和的、直链或支链的、环状(包括单环和多环、稠合和非稠合多环)或非环状的。
[0025]
(c
1-c
50
)杂烃基可以是未经取代的或经取代的。(c
1-c
50
)杂烃基的非限制性示例包括(c
1-c
50
)杂烷基、(c
1-c
50
)烃基-o-、(c
1-c
50
)烃基-s-、(c
1-c
50
)烃基-s(o)-、(c
1-c
50
)烃基-s(o)
2-、(c
1-c
50
)烃基-si(rc)
2-、(c
l-c
50
)烃基-n(rn)-、(c
l-c
50
)烃基-p(r
p
)-、(c
2-c
50
)杂环烷基、(c
2-c
19
)杂环烷基-(c
1-c
20
)亚烷基、(c
3-c
20
)环烷基-(c
1-c
19
)杂亚烷基、(c
2-c
19
)杂环烷基-(c
1-c
20
)杂亚烷基、(c
1-c
50
)杂芳基、(c
1-c
19
)杂芳基-(c
1-c
20
)亚烷基、(c
6-c
20
)芳基-(c
1-c
19
)杂亚烷基,或(c
1-c
19
)杂芳基-(c
1-c
20
)杂亚烷基。
[0026]
术语“(c
1-c
50
)杂芳基”意指具有共1到50个碳原子和1到10个杂原子的未被取代的或被(一个或多个rs)取代的单环、双环或三环杂芳香族烃自由基。单环杂芳香族烃基团包括一个杂芳香族环;双环杂芳香族烃基团具有两个环;并且三环杂芳香族烃基团具有三个环。当双环或三环杂芳香族烃自由基存在时,该自由基中的环中的至少一个环是杂芳香族的。杂芳香族基团的其他一个或多个环可以独立地是稠合或非稠合的并且是芳香族或非芳香族的。其他杂芳基基团(例如,通常是(c
x-cy)杂芳基,诸如(c
1-c
12
)杂芳基)以类似的方式定义为具有x到y个碳原子(诸如1个至12个碳原子)并且是未被取代的或被一个或多于一个rs取代的。单环杂芳香族烃基团是5元环或6元环。5元环单环杂芳香族烃基团具有5减h个碳原子,其中h是杂原子的数量并且可以是1、2、3或4,并且每个杂原子可以是o、s、n或p。5元环杂芳香族烃基团的示例包括:吡咯-1-基;哌啶-2-基;呋喃-3-基;噻吩-2-基;吡唑-1-基;异噁唑-2-基;异噻唑-5-基;咪唑-2-基;噁唑-4-基;噻唑-2-基;1,2,4-三唑-1-基;1,3,4-噁二唑-2-基;1,3,4-噻二唑-2-基;四唑-1-基;四唑-2-基;和四唑-5-基。6元环单环杂芳香族烃基团具有6减h个碳原子,其中h为杂原子的数目并且可以为1或2,并且杂原子可以为n或p。6元环杂芳香族烃基团的示例包括:吡啶-2-基;嘧啶-2-基;和吡嗪-2-基。双环杂芳香烃基可以是稠合的5,6-或6,6-环系。稠合的5,6-环系双环杂芳香族烃基的示例为吲哚-1-基;和苯并咪唑-1-基。稠合的6,6-环系双环杂芳香族烃基的示例为喹啉-2-基;和异喹啉-1-基。双环杂芳香烃基可以是稠合的5,6,5-环系;5,6,6-环系;6,5,6-环系;或6,6,6-环系。稠合的5,6,5-环系的示例为1,7-二氢吡咯并[3,2-f]吲哚-1-基。稠合的5,6,6-环系的示例为1h-苯并[f]吲哚-1-基。稠合的6,5,6-环系的示例是9h-咔唑-9-基。稠合的6,5,6-环系的示例是9h-咔唑-9-基。稠合的6,6,6-环系的示例是吖啶-9-基。
[0027]
术语“(c
1-c
50
)杂烷基”意指含有一到五十个碳原子和一个或多个杂原子的饱和直链或支链基团。术语“(c
1-c
50
)杂亚烷基”意指含有1到50个碳原子和一个或多于一个杂原子的饱和直链或支链双基团。杂烷基或杂亚烷基的杂原子可包括si(rc)3、ge(rc)3、si(rc)2、ge(rc)2、p(r
p
)2、p(r
p
)、n(rn)2、n(rn)、n、o、orc、s、src、s(o)和s(o)2,其中杂烷基和杂亚烷基基团中的每一者未被取代或被一个或多个rs取代。
[0028]
未经取代的(c
2-c
40
)杂环烷基的示例包括未经取代的(c
2-c
20
)杂环烷基、未经取代的(c
2-c
10
)杂环烷基、氮丙啶-1-基、氧杂环丁-2-基、四氢呋喃-3-基、吡咯烷-1-基、四氢噻吩-s,s-二氧化-2-基、吗啉-4-基、1,4-二噁烷-2-基、六氢吖庚因-4-基、3-氧杂-环辛基、5-硫代-环壬基以及2-氮杂-环癸基。
[0029]
术语“卤素原子”或“卤素”意指氟原子(f)、氯原子(cl)、溴原子(br)或碘原子(i)的自由基。术语“卤化物”意指卤素原子的阴离子形式:氟离子(f-)、氯离子(cl-)、溴离子
(br-)或碘离子(i-)。
[0030]
术语“饱和”意指缺少碳-碳双键、碳-碳三键以及(在含有杂原子的基团中)碳-氮双键、碳-磷双键和碳-硅双键。在饱和化学基团被一个或多个取代基rs取代的情况下,一个或多个双键和/或三键任选地可以存在于取代基rs中。术语“不饱和”意指含有一个或多个碳-碳双键或碳-碳三键或者(在含有杂原子的基团中)一个或多个碳-氮双键、碳-磷双键或碳-硅双键,不包括可以存在于取代基rs(如果有的话)中或芳香族环中或杂芳香族环中的双键(如果有的话)。
[0031]
本公开的实施方案包括一种或多种催化剂体系。所述催化剂体系包含一种或多种根据式(i)的金属-配体络合物:
[0032][0033]
在式(i)中,m为选自钛、锆或铪的金属,所述金属具有 2、 3或 4的形式氧化态;每个x是独立地选自不饱和(c
2-c
50
)烃、不饱和(c
2-c
50
)杂烃、(c
1-c
50
)烃基、(c
6-c
50
)芳基、(c
6-c
50
)杂芳基、环戊二烯基、经取代的环戊二烯基、(c
4-c
12
)二烯、卤素和-ch2sir
c3
的单齿或二齿配体;其中每个rc选自由以下项组成的组:(c
1-c
30
)烃基或
–
h。在式(i)中,(x)n的下标n为2或3,并且下标m为1或2。所述式(i)的金属-配体络合物具有6个或更少的金属-配体键。
[0034]
在式(i)中,每个r1独立地选自由以下项组成的组:(c
1-c
50
)烷基或(c
6-c
50
)芳基;每个r2、r3和r4独立地选自
–
h、(c
1-c
50
)烃基、(c
1-c
50
)杂烃基、(c
6-c
50
)芳基、(c
4-c
50
)杂芳基、-orc、-si(rc)3和-ge(rc)3;每个r5选自s、-nrn或cr
n2
,其中每个rn为(c
1-c
20
)烃基或-h;并且每个r6独立地选自
–
h、(c
1-c
50
)烃基、(c
1-c
50
)杂烃基、(c
6-c
50
)芳基、(c
4-c
50
)杂芳基、-si(rc)3和-ge(rc)3。
[0035]
在式(i)的金属-配体络合物的一个或多个实施方案中,m为锆或铪;每个x独立地选自未经取代的(c
1-c
10
)烷基、经取代的(c
1-c
10
)烷基、(c
6-c
20
)芳基或卤素;并且每个r1独立地选自(c
6-c
50
)芳基或(c
1-c
50
)烷基。
[0036]
在一些实施方案中,每个r3、r4和r5为
–
h。
[0037]
在各种实施方案中,每个r1是未经取代的苯基、经取代的苯基、未经取代的蒽基、经取代的蒽基、未经取代的萘基或经取代的萘基。在一个或多个实施方案中,每个r1是经取代的苯基;经取代的苯基选自2-甲基苯基、2-(异丙基)苯基、2,4,6-三甲基苯基、2,6-二(异丙基)苯基、2,4,6-三(异丙基)苯基、3,5-二叔丁基苯基、3,5-二苯基苯基、2,3,5,6-四氟苯基。
[0038]
在各种实施方案中,r5为nrn,其中rn为(c
1-c
20
)烷基或(c
6-c
20
)芳基;在一些实施方案中,rn为直链(c
1-c
12
)烷基。
[0039]
在实施方案中,金属-配体络合物可以包括两个二齿配体,其中m为2并且金属-配
体络合物具有根据式(ii)的结构:
[0040][0041]
在式(ii)中,每个r1、r2、r3、r4、r5、r6和x如式(i)中所定义;并且n为1或2。
[0042]
在根据式(i)或式(ii)的金属-配体络合物中,每个x通过共价键、配价键或离子键与m键合。在一些实施方案中,每个x是相同的。金属-配体络合物具有6个或更少的金属-配体键,并且可以是总体电荷中性的,或者可以具有与金属中心相关的正电荷。在一些实施方案中,催化剂体系包含根据式(i)的金属-配体络合物,其中m为锆或铪;每个x独立地选自(c
1-c
20
)烷基、(c
1-c
20
)杂烷基、(c
6-c
20
)芳基、(c
4-c
20
)杂芳基、(c
4-c
12
)二烯或卤素。在一个或多个实施方案中,每个x独立地为苄基、苯基或氯。
[0043]
在一些实施方案中,单齿配体可以是单阴离子配体。单阴离子配体的净形式氧化态为-1。每个单阴离子配体可以独立地为氢化物、(c
1-c
40
)烃基碳负离子、(c
1-c
40
)杂烃基碳负离子、卤离子、硝酸根、碳酸根、磷酸根、硫酸根、hc(o)o-、hc(o)n(h)-、(c
1-c
40
)烃基c(o)o-、(c
1-c
40
)烃基c(o)n((c
1-c
20
)烃基)-、(c
1-c
40
)烃基c(o)n(h)-、r
krl
b-、r
krl
n-、rko-、rks-、r
krl
p-或r
mrkrl
si-,其中每个rk、r
l
和rm独立地为氢、(c
1-c
40
)烃基或(c
1-c
40
)杂烃基,或者rk和r
l
合在一起形成(c
2-c
40
)亚烃基或(c
1-c
20
)杂亚烃基并且rm如上文所定义。
[0044]
在其他实施方案中,独立于任何其他配体x的至少一个单齿配体x可以是中性配体。在具体的实施方案中,中性配体是中性路易斯碱基团,诸如rqnr
krl
、rkor
l
、rksr
l
或rqpr
krl
,其中每个rq独立地为氢、[(c
1-c
10
)烃基]3si(c
1-c
10
)烃基、(c
1-c
40
)烃基、[(c
1-c
10
)烃基]3si或(c
1-c
40
)杂烃基,并且每个rk和r
l
独立地如先前所定义。
[0045]
另外,每个x可以是单齿配体,该单齿配体独立于任何其他配体x为卤素、未经取代的(c
1-c
20
)烃基、未经取代的(c
1-c
20
)烃基c(o)o
–
或r
krl
n-,其中rk和r
l
中的每一者独立地为未经取代的(c
1-c
20
)烃基。在一些实施方案中,每个单齿配体x是氯原子、(c
1-c
10
)烃基(例如,(c
1-c6)烷基或苄基)、未经取代的(c
1-c
10
)烃基c(o)o
–
或r
krl
n-,其中rk和r
l
中的每一者独立地为未经取代的(c
1-c
10
)烃基。在式(i)、(ii)和(iii)的一个或多个实施方案中,x为苄基、氯、-ch2sime3或苯基。
[0046]
在另外的实施方案中,每个x选自:甲基;乙基;1-丙基;2-丙基;1-丁基;2,2-二甲基丙基;三甲基甲硅烷基甲基;苯基;苄基;或氯。在一些实施方案中,每个x都是相同的。在其他实施方案中,至少两个x彼此不相同。在其中至少两个x与至少一个x不同的实施方案中,x为以下中的不同一者:甲基;乙基;1-丙基;2-丙基;1-丁基;2,2-二甲基丙基;三甲基甲硅烷基甲基;苯基;苄基;和氯。在另外的实施方案中,二齿配体为2,2-二甲基-2-二甲基硅烷-l,3-二基或1,3-丁二烯。
[0047]
在一些实施方案中,式(i)的金属-配体络合物的化学基团(例如,x和r
1-r4)中的任一者或全部可以是未经取代的。在其他实施方案中,式(i)的金属-配体络合物的化学基团x和r
1-r4中没有、任一者或全部可以被一个或多于一个rs取代。当两个或多于两个rs与式(i)
的金属-配体络合物的同一化学基团键合时,化学基团的各个rs可以与同一碳原子或杂原子或者与不同的碳原子或杂原子键合。在一些实施方案中,化学基团x和r
1-r4中没有、任一者或全部可以被rs全取代。在被rs全取代的化学基团中,各个rs可以全部相同或可以独立地选择。
[0048]
在说明性实施方案中,催化剂体系可以包含根据式(i)的具有以下列出的金属-配体1至13中的任一者的结构的金属-配体络合物:
[0049]
[0050][0051]
[0052]
在说明性实施方案中,催化剂体系可以包含根据式(i)的具有金属-配体络合物1至13中的任一者的结构的金属-配体络合物,或由以下相应配体合成的原位形成的金属-配体络合物:
[0053]
[0054]
[0055]
[0056]
[0057][0058]
本公开的实施方案包括聚合方法。聚合方法包括在存在催化剂体系的情况下在烯烃聚合条件下使乙烯和一种或多种烯烃聚合以形成基于乙烯的聚合物,该催化剂体系包含根据式(i)或式(ii)的金属-配体络合物。
[0059]
本公开的一个或多个实施方案包括聚合聚合物的方法,该方法包括:在反应器中在存在催化剂体系的情况下接触乙烯和任选地一种或多种(c
3-c
12
)α-烯烃。催化剂体系可以包括根据式(i)的金属-配体络合物的主催化剂以及活化剂。聚合方法可以包括但不限于例如使用一种或多种反应器的溶液聚合法、气相聚合法、浆相聚合法以及它们的组合,该一种或多种反应器诸如环式反应器、等温反应器、流化床气相反应器、连续搅拌槽反应器、并联或串联的间歇式反应器和/或它们的任何组合。
[0060]
本公开的聚合方法可以产生基于乙烯的聚合物,例如乙烯和任选地一种或多种共聚单体诸如α-烯烃的均聚物和/或互聚物(包括共聚物)可以例如使用一个或多个环流反应器、等温反应器以及它们的组合通过溶液相聚合方法生产。
[0061]
在一些实施方案中,溶液相聚合方法在一个或多个充分搅拌的反应器诸如一个或多个环管反应器或者一个或多个球形等温反应器中,在120℃至300℃范围内、例如150℃至190℃范围内的温度下并且在300psi至1500psi范围内、例如400psi至750psi范围内的压力下发生。溶液相聚合方法中的停留时间通常在2分钟至30分钟;例如10分钟至20分钟的范围内。将乙烯、一种或多种溶剂、一种或多种催化剂体系(诸如包括根据式(i)的金属-配体络合物的主催化剂的催化剂体系)、任选地一种或多种助催化剂和任选地一种或多种共聚单体连续进料至一个或多个反应器中。示例性溶剂包括但不限于异链烷烃。例如,此类溶剂可以名称isopar e从exxonmobil chemical co.,houston,texas购得。然后从反应器中去除基于乙烯的聚合物和溶剂的所得混合物,并且分离基于乙烯的聚合物。溶剂通常经由溶剂回收单元(即,热交换器和蒸汽液体分离器转鼓)回收,并且随后再循环回到聚合系统中。
[0062]
链穿梭剂和/或链转移剂
[0063]
在一个或多个实施方案中,本公开的聚合方法包括在存在催化剂体系和链转移剂或链穿梭剂的情况下在反应器中接触乙烯和/或一种或多种(c
3-c
12
)α-烯烃。在此类实施方案中,聚合方法包括三种组分:(a)包含具有式(i)结构的金属-配体络合物的主催化剂和任选地助催化剂;(b)具有与主催化剂(a)不同的共聚单体选择性的烯烃聚合催化剂;以及(c)链转移剂或链穿梭剂。
[0064]
作为催化剂体系的添加剂,链转移剂和链穿梭剂是能够在单个聚合反应器中的两个催化剂分子之间转移聚合物链的化合物。催化剂分子可以具有相同的结构或不同的结构。当催化剂分子具有不同的结构时,它们可能具有不同的单体选择性。这些化合物充当链
转移剂或充当链穿梭剂取决于聚合反应器的类型,即使前面描述的三种组分(a)-(c)在任何一种类型的聚合反应器中可能在化学上是相同的。例如,在具有单催化剂体系或双催化剂体系的间歇式反应器中,化合物充当链转移剂。在具有双催化剂体系的连续反应器中,这些化合物充当链穿梭剂。通常,用作间歇式反应器中的链转移剂的化合物也可以用作连续反应器中的链穿梭剂;相反地,用作链穿梭剂的分子也可以用作链转移剂。因此,在本公开的聚合方法的实施方案中,应当理解,作为“链转移剂”的化合物的公开进一步构成了作为“链穿梭剂”的相同化合物的公开。因此,术语“链转移剂”和“链穿梭剂”相对于化学化合物是可互换的,但是当指定在特定种类的聚合反应器内发生过程时,它们是可区分的。
[0065]
催化剂的链转移能力最初是通过开展改变链转移剂或穿梭剂(csa)水平以观察分子量的下降和对预期的穿梭催化剂的pdi的整体影响的活动来评估的。与通过表现出较差的穿梭或缓慢的链转移动力学的催化剂生成的聚合物分子量相比,由具有潜力成为良好链穿梭剂的催化剂生成的聚合物的分子量将对csa的添加更敏感。梅奥方程(mayo equation)(方程1)描述了链转移剂如何从不存在链转移剂的天然数均链长减少数均链长方程2将链转移或链穿梭常数ca定义为链转移与增长速率常数之比。通过假设绝大多数链增长是通过乙烯插入而不是共聚单体掺入而发生的,方程3描述聚合的预期mn。mn0是在不存在链穿梭剂的情况下催化剂的天然分子量,并且mn是在链穿梭剂的情况下观察到的分子量(mn=mn0,无链穿梭剂)。
[0066][0067][0068][0069]
[单体]=(摩尔%c2)
×
[乙烯] (摩尔%c8)
×
[辛烯]
ꢀꢀꢀ
公式4
[0070]
通常,链转移剂包含形式氧化态为 3的al、b或ga金属;或形式氧化态为 2的zn或mg金属。适用于本公开的方法的链转移剂描述于美国专利申请公开号us2007/0167315中,其通过引用整体并入本文。
[0071]
在聚合方法的一个或多个实施方案中,链转移剂(当存在时)可以选自二乙基锌、二(异丁基)锌、二(正己基)锌、二(正辛基)锌、三乙基铝、三辛基铝、三乙基镓、双(二甲基(叔丁基)硅氧烷)异丁基铝、双(二(三甲基甲硅烷基)酰胺)异丁基铝、二(吡啶-2-甲醇)正辛基铝、双(正十八烷基)异丁基铝、双(二(正戊基)酰胺)异丁基铝、双(2,6-二叔丁基苯酚)正辛基铝、二(乙基(l-萘基)酰胺)正辛基铝、双(叔丁基二甲基硅氧烷)乙基铝、二(双(三甲基甲硅烷基)酰胺)乙基铝、双(2,3,6,7-二苯并-l-氮杂环庚烷酰胺)乙基铝、双(2,3,6,7-二苯并-l-氮杂环庚烷酰胺)正辛基铝、双(二甲基(叔丁基)硅氧化物正辛基铝、(2,6-二苯基苯酚)乙基锌、(叔丁醇)乙基锌、二甲基镁、二丁基镁和正丁基-仲丁基镁。
[0072]
助催化剂组分
[0073]
通过本领域已知的用于使烯烃聚合反应的基于金属的催化剂活化的任何技术,可以使包括式(i)的金属-配体络合物的催化剂体系呈现催化活性。举例来说,可通过使络合
物与活化助催化剂接触或使络合物与活化助催化剂组合使根据式(i)的金属-配体络合物的主催化剂显现催化活性。另外,根据式(i)的金属-配体络合物包含中性的主催化剂形式和可能由于丧失单体离子配体(如苄基或苯基)而带正电荷的催化形式两者。适用于本文的活化助催化剂包括烷基铝;聚合或低聚铝氧烷(也称为铝氧烷);中性路易斯酸;以及非聚合、非配位、离子形成化合物(包括在氧化条件下使用此类化合物)。合适的活化技术是本体电解。还设想了前述活化助催化剂和技术中的一种或多种的组合。术语“烷基铝”意指二氢化单烷基铝或二卤化单烷基铝、氢化二烷基铝或卤化二烷基铝、或三烷基铝。聚合或低聚铝氧烷的示例包含甲基铝氧烷、经过三异丁基铝改性的甲基铝氧烷和异丁基铝氧烷。
[0074]
在一些实施方案中,合适的助催化剂包括聚合或低聚铝氧烷(尤其是甲基铝氧烷)以及惰性相容性非配位离子形成化合物。示例性合适的助催化剂包括但不限于改性的甲基铝氧烷(mmao)、双(氢化牛脂烷基)甲基、四(五氟苯基)硼酸(1-)胺(ribs-2)、三乙基铝(tea)以及它们的组合。
[0075]
路易斯酸活化助催化剂包含含有如本文所述的(c
1-c
20
)烃基取代基的第13族金属化合物。在一些实施方案中,第13族金属化合物是三((c
1-c
20
)烃基)取代的铝或三((c
1-c
20
)烃基)-硼化合物。在其他实施方案中,第13族金属化合物是三(烃基)取代的铝、三((c
1-c
20
)烃基)-硼化合物、三((c
1-c
10
)烷基)铝、三((c
6-c
18
)芳基)硼化合物及其卤代(包括全卤代)衍生物。在另外的实施方案中,第13族金属化合物为三(氟取代的苯基)硼烷、三(五氟苯基)硼烷。在一些实施方案中,活化助催化剂是三((c
1-c
20
)烃基硼酸盐(例如,三苯甲基四氟硼酸盐)或三((c
1-c
20
)烃基)铵四((c
1-c
20
)烃基)硼烷(例如,双(十八烷基)甲基铵四(五氟苯基)硼烷)。如本文所用,术语“铵”意指氮阳离子,其为((c
1-c
20
)烃基)4n
、((c
1-c
20
)烃基)3n(h)
、((c
1-c
20
)烃基)2n(h)
2
、(c
1-c
20
)烃基
3
或n(h)
4
,其中在存在两个或多个(c
1-c
20
)烃基时,其各自可相同或不同。
[0076]
中性路易斯酸活化助催化剂的组合包含包括三((c
1-c4)烷基)铝和卤化三((c
6-c
18
)芳基)硼化合物(尤其是三(五氟苯基)甲硼烷)的组合的混合物。其他实施方案是此类中性路易斯酸混合物与聚合或低聚铝氧烷的组合以及单一中性路易斯酸(尤其是三(五氟苯基)硼烷)与聚合或低聚铝氧烷的组合。(金属-配体络合物)的摩尔数比:(三(五氟苯基)硼烷):(铝氧烷)[例如,(第4族金属-配体络合物):(三(五氟苯基)硼烷):(铝氧烷)]的摩尔数的比率为1:1:1到1:10:30,在其他实施方案中为1:1:1.5到1:5:10。
[0077]
包含式(i)的金属-配体络合物的催化剂体系可以被活化,以通过与一种或多种助催化剂(例如,阳离子形成的助催化剂、强路易斯酸或其组合)组合来形成活性催化剂组合物。适合的活化助催化剂包含聚合或低聚铝氧烷(尤其是甲基铝氧烷)以及惰性、相容性、非配位、形成离子的化合物。示例性适合的助催化剂包括但不限于改性的甲基铝氧烷(mmao)、双(氢化牛脂烷基)甲基、四(五氟苯基)硼酸(1-)胺以及它们的组合。
[0078]
在一些实施方案中,前述活化助催化剂中的一种或多种活化助催化剂可以彼此组合使用。助催化剂组合的具体示例为三((c
1-c4)烃基)铝、三((c
1-c4)烃基)硼烷或硼酸铵与低聚或聚合铝氧烷化合物的混合物。一种或多种式(i)的金属-配体络合物的总摩尔数与活化助催化剂中的一种或多种活化助催化剂的总摩尔数的比率为1:10,000至100:1。在一些实施方案中,比率为至少1:5000,在一些其他实施方案中为至少1:1000;以及10:1或更小,并且在一些其他实施方案中为1:1或更小。当铝氧烷单独用作活化助催化剂时,优选地,所
采用的铝氧烷的摩尔数是式(i)的金属-配体络合物的摩尔数的至少100倍。在一些其他实施方案中,当单独使用三(五氟苯基)硼烷作为活化助催化剂时,所采用的三(五氟苯基)硼烷的摩尔数与一种或多种式(i)的金属-配体络合物的总摩尔数之比为0.5:1至10:1、1:1至6:1或1:1至5:1。剩余的活化助催化剂通常以大约等于式(i)的一种或多种金属-配体络合物的总摩尔量的摩尔量采用。
[0079]
聚烯烃
[0080]
利用前述段落中描述的催化体系来使烯烃,主要是乙烯和丙烯聚合。在一些实施方案中,聚合方案中仅存在单一类型的烯烃或α-烯烃,从而形成均聚物。然而,可将另外的α-烯烃掺入到聚合程序中。另外的α-烯烃共聚单体通常具有不超过20个碳原子。例如,α-烯烃共聚单体可具有3个至10个碳原子或3个至8个碳原子。示例性α-烯烃共聚单体包括但不限于丙烯、1-丁烯、1-戊烯、1-己烯、1-庚烯、1-辛烯、1-壬烯、1-癸烯和4-甲基-1-戊烯。例如,一种或多种α-烯烃共聚单体可以选自由以下项组成的组:丙烯、1-丁烯、1-己烯和1-辛烯;或者在替代方案中,选自由以下项组成的组:1-己烯和1-辛烯。
[0081]
例如,基于乙烯的聚合物、乙烯的均聚物和/或互聚物(包含共聚物)和任选地一种或多种如α-烯烃等共聚单体可以包括至少50重量百分比的衍生自乙烯的单体单元。“至少50重量百分比”所涵盖的所有单个值和子范围在本文中作为单独的实施方案公开;例如,基于乙烯的聚合物,即乙烯与任选地一种或多种诸如α-烯烃的共聚单体的均聚物和/或互聚物(包括共聚物),可以包含至少60重量百分比的衍生自乙烯的单体单元;至少70重量百分比的衍生自乙烯的单体单元;至少80重量百分比的衍生自乙烯的单体单元;或50重量%至100重量百分比的衍生自乙烯的单体单元;或80重量%至100重量百分比的衍生自乙烯的单元。
[0082]
在一些实施方案中,基于乙烯的聚合物可以包括至少90摩尔百分比的衍生自乙烯的单元。来自至少90摩尔百分比的所有个别值和子范围包含在本文中并且在本文中作为单独的实施方案公开。例如,基于乙烯的聚合物可包含至少93摩尔%的衍生自乙烯的单元;至少96摩尔%的单元;至少97摩尔%的衍生自乙烯的单元;或另选地,90摩尔%至100摩尔%的衍生自乙烯的单元;90摩尔%至99.5摩尔%的衍生自乙烯的单元;或97摩尔%至99.5摩尔%的衍生自乙烯的单元。
[0083]
在基于乙烯的聚合物的一些实施方案中,另外的α-烯烃的量小于50%;其他实施方案包括至少0.5摩尔百分比(摩尔%)至25摩尔%;并且在另外的实施方案中,另外的α-烯烃的量包括至少5摩尔%至10摩尔%。在一些实施方案中,另外的α-烯烃是1-辛烯。
[0084]
可以采用任何常规聚合工艺来产生乙烯类聚合物。这种常规聚合方法包括但不限于例如使用一种或多种常规反应器的溶液聚合法、气相聚合法、浆相聚合法和其组合,所述一种或多种常规反应器如环式反应器、等温反应器、流化床气相反应器、搅拌槽反应器、并联或串联的间歇反应器或它们的任何组合。
[0085]
在一个实施方案中,可以在双反应器系统(例如双环式反应器系统)中通过溶液聚合产生乙烯类聚合物,其中乙烯和任选的一种或多种α-烯烃在存在如本文所述的催化剂体系以及任选的一种或多种助催化剂的情况下聚合。在另一个实施方案中,基于乙烯的聚合物可以在双反应器系统,例如双环管反应器系统中通过溶液聚合产生,其中乙烯和任选地一种或多种α-烯烃在存在本公开中的并且如本文所述的催化剂体系以及任选的一种或多
种其他催化剂的情况下聚合。如本文所描述的催化剂体系可以任选地与一种或多种其他催化剂组合地用于第一反应器或第二反应器中。在一个实施方案中,基于乙烯的聚合物可以在双反应器系统(例如双环管反应器系统)中经由溶液聚合产生,其中乙烯和任选地一种或多种α-烯烃在存在如本文所述的催化剂体系的情况下在这两个反应器中聚合。
[0086]
在另一个实施方案中,基于乙烯的聚合物可以在单反应器系统(例如单环管反应器系统)中通过溶液聚合产生,其中乙烯和任选地一种或多种α-烯烃在存在如本公开内所述的催化剂体系和如前面段落中所述的任选的一种或多种助催化剂的情况下聚合。
[0087]
基于乙烯的聚合物可以进一步包括一种或多种添加剂。这种添加剂包括但不限于抗静电剂、颜色增强剂、染料、润滑剂、颜料、主抗氧化剂、次级抗氧化剂、加工助剂、uv稳定剂和它们的组合。基于乙烯的聚合物可以含有任何量的添加剂。基于乙烯的聚合物可包含按基于乙烯的聚合物和一种或多种添加剂的重量计约0至约10%的这类添加剂的组合重量。基于乙烯的聚合物可以进一步包括填充剂,所述填充剂可以包含但不限于有机或无机填充剂。按基于乙烯的聚合物和所有添加剂或填充剂的组合重量计,基于乙烯的聚合物可以含有约0到约20重量百分比的填充剂,例如,碳酸钙、滑石粉或mg(oh)2。基于乙烯的聚合物可以进一步与一种或多种聚合物共混以形成共混物。
[0088]
在一些实施方案中,用于产生基于乙烯的聚合物的聚合方法可以包含在存在催化剂体系的情况下使乙烯和至少一种另外的α-烯烃聚合,其中该催化剂体系掺入至少一种式(i)的金属-配体络合物。根据astm d792(全文以引用方式并入本文),由掺入式(i)的金属-配体络合物的此类催化剂体系产生的聚合物可以具有例如0.850g/cm3至0.950g/cm3、0.880g/cm3至0.920g/cm3、0.880g/cm3至0.910g/cm3或0.880g/cm3至0.900g/cm3的密度。
[0089]
在另一个实施方案中,由包含式(i)的金属-配体络合物的催化剂体系产生的聚合物的熔体流动比(i
10
/i2)为5至15,其中熔体指数i2是根据astm d1238(全文以引用方式并入本文)在190℃和2.16kg负载下测量的,并且熔体指数i
10
是根据astm d1238在190℃和10kg负载下测量的。在其他实施方案中,熔融流动比(i
10
/i2)为5至10,并且在另外的实施方案中,熔融流动比为5至9。
[0090]
在一些实施方案中,由包括式(i)的金属-配体络合物的催化剂体系产生的聚合物的分子量分布(mwd)为1至25,其中mwd定义为mw/mn,其中mw为重均分子量,并且mn为数均分子量。在其他实施方案中,由催化剂体系产生的聚合物的mwd为1至6。另一实施方案包括1到3的mwd;并且其他实施方案包括1.5到2.5的mwd。
[0091]
由于形成的聚合物的高分子量和掺入聚合物中的共聚单体的量,本公开中所描述的催化剂体系的实施方案产生独特的聚合物性质。
[0092]
除非另有说明,否则所有溶剂和试剂均从商业来源获得并按原样使用。通过活性氧化铝,在某些情况下,通过q-5反应物纯化无水甲苯、己烷、四氢呋喃和二乙醚。用于在氮气填充的手套箱中进行的实验的溶剂通过在活化的分子筛上储存而进一步干燥。用于水分敏感反应的玻璃器皿在使用前在烘箱中干燥过夜。在varian 400-mr和vnmrs-500光谱仪上记录nmr光谱。使用与沃特世2424els检测器(waters 2424 els detector)、沃特世2998pda检测器(waters 2998 pda detector)以及沃特世3100esi质量检测器(waters 3100 esi mass detector)耦合的沃特世e2695分离模块(waters e2695 separations module)进行lc-ms分析。在xbridge c18 3.5μm 2.1
×
50mm柱上进行lc-ms分离,使用乙腈
与水的比例为5:95到100:0的梯度,使用0.1%甲酸作为电离剂。使用具有zorbax eclipse plus c18 1.8μm 2.1
×
50mm柱的安捷伦1290无限lc(agilent 1290 infinity lc)进行hrms分析,该柱与具有电喷雾电离的安捷伦6230 tof质谱仪(agilent 6230 tof mass spectrometer)耦合。1h nmr数据报告如下:化学位移(多重性(br=宽、s=单重态、d=双重态、t=三重态、q=四重态、p=五重态、sex=六重态、sept=七重态并且m=多重态)、整合和赋值)。使用氘代溶剂中残留的质子为参考,从内部四甲基硅烷(tms,标度δ)的低场报告了1h nmr数据的化学位移(以ppm为单位)。采用1h去耦法测定了
13
c nmr数据,并且与使用氘代溶剂中残留的质子作为参考相比,从四甲基硅烷(tms,标度δ)的低场报告了化学位移(以ppm为单位)。
[0093]
高通量平行聚合反应器聚合程序(ppr)筛选
[0094]
聚烯烃催化筛选在高通量平行聚合反应器(ppr)系统中执行。ppr系统包括惰性气氛手套箱中的48个单独单元(6
×
8矩阵)反应器阵列。每个单元配备有内部工作液体体积约为5ml的玻璃插件。每个单元都有独立的压力控制件,并以800rpm的频率连续搅拌。除非另有说明,否则在甲苯中制备催化剂溶液。通过机器人注射器添加所有液体(即,溶剂、1-辛烯、链穿梭剂溶液和催化剂溶液)。通过气体注入口添加气态试剂(即,乙烯、co)。在每次运行之前,将反应器加热至80℃,用乙烯吹扫,并排气。
[0095]
将反应器加热至运行温度,并用乙烯加压至合适的psig。添加isopar e waiss,然后按以下顺序添加试剂的甲苯溶液:(1)1-辛烯与500nmol清除剂mmao-3a;(2)活化剂(ribs-ii、fab等);和(3)催化剂(100nmol)。
[0096]
每次添加液体时都用少量isopar e进行跟踪,以便在最后添加后达到5ml的总反应体积。添加催化剂后,ppr软件开始监测每个单元的压力。通过在设定点为负1psi时打开阀门,并在压力高于2psi时关闭阀门,通过补充添加乙烯气体来维持所需压力(大约2psig至6psig内)。所有压力下降在运行期间累积记录为乙烯的“吸收”或“转化”,或者直到达到吸收或转化要求值为止,以先发生的情况为准。在比反应器压力更高的40psi至50psi下,通过在氩气中添加10%一氧化碳将每个反应淬灭4分钟。“淬灭时间”越短,催化剂的活性越高。为了防止在任何给定的单元中形成太多的聚合物,在达到预定吸收水平(120℃运行为50psig,150℃运行为75psig)后淬灭反应。淬灭反应器后,使其冷却至70℃,排气,用氮气吹扫5分钟以去除一氧化碳,并取出管。然后将聚合物样品在离心蒸发器中于70℃下干燥12小时,称重以确定聚合物收率,并进行ir(1-辛烯掺入)和gpc(分子量)分析。
[0097]
间歇式反应器聚合程序
[0098]
间歇式反应器聚合在2l的parr
tm
间歇式反应器中进行。反应器通过电加热罩加热并且通过含有冷却水的内部蜿蜒的冷却盘管冷却。通过camile
tm
tg过程计算机控制和监测反应器和加热/冷却系统。反应器的底部装配有倾泄阀,该倾泄阀将反应器内容物排空到不锈钢倾泄锅中,该倾泄锅预填充有催化剂杀灭溶液(通常为5ml的irgafos/irganox/甲苯混合物)。将倾泄锅排放到30加仑吹排污罐,其中该锅和该罐均用氮气吹扫。用于聚合或催化剂组成的所有溶剂都通过溶剂纯化柱,以去除任何可能影响聚合的杂质。使1-辛烯和isopar e穿过两个柱,第一个柱含有活性a2氧化铝,第二个柱含有活性q5反应物。使乙烯穿过两个柱,第一个柱含有a204氧化铝和分子筛,第二个柱含有q5反应物。用于转移的n2穿过含有a204氧化铝、分子筛和q5的单个柱。
[0099]
根据所需反应器载荷,首先从含有isopar e溶剂和/或1-辛烯的喷射罐装载反应器。通过使用安装有喷射罐的实验室规模将喷射罐填充到载荷设定点。添加液体进料后,将反应器加热到聚合温度设定点。如果使用乙烯,则在反应温度处将其添加到反应器中以保持反应压力设定点。通过微运动流量计监测乙烯添加量。
[0100]
将催化剂和活化剂与适量的纯化甲苯混合以获得期望摩尔浓度的溶液。将催化剂和活化剂在惰性手套箱中处理,吸入注射器中,并将压力转移到催化剂喷射罐中。然后用甲苯冲洗三次,每次5ml。添加催化剂后,立即开始运行计时器。如果使用乙烯,则通过camile添加乙烯以保持反应器中的反应压力设定点。这些聚合运行10分钟,然后停止搅拌器,并且打开底部排放阀以将反应器内容物排空到倾泄锅中。将倾泄锅内容物倒入放置在实验通风橱中的托盘中,在托盘中蒸发掉溶剂过夜。然后将含有剩余聚合物的托盘转移到真空烘箱中,在该真空烘箱中将其在真空下加热至高达140℃以去除任何剩余溶剂。在托盘冷却到环境温度后,称重聚合物以获得收率/效率,并且提交供聚合物测试。
[0101]
使用ir检测辛烯掺入的ht-gpc分析
[0102]
使用配备有polymerchar红外检测器(ir5)和agilent plgel mixed a色谱柱的陶氏(dow)robot assisted delivery(rad)系统进行高温gpc分析。将癸烷(10μl)添加到每个样品中,以用作内部流动标志物。首先在用300ppm丁羟甲苯(bht)稳定的1,2,4-三氯苯(tcb)中将样品稀释到10mg/ml的浓度,然后通过在160℃下搅拌120分钟来将其溶解。在注射前,通过用bht稳定的tcb将样品进一步稀释到2mg/ml的浓度。将样品(250μl)通过一个pl-gel 20μm(50mm
×
7.5mm)保护柱洗脱,随后再通过两个pl-gel 20μm(300mm
×
7.5mm)mixed-a柱洗脱,维持在160℃,将tcb用bht稳定,流速为1.0ml/min。总运行时间为24分钟。为了校准分子量,将安捷伦easical聚苯乙烯标准品(ps-1和ps-2)用1.5ml的用bht稳定的tcb稀释,并通过在160℃下搅拌15分钟使其溶解。将ps标准品注入系统中而无需进一步稀释以创建3阶mw校准曲线,其中使用已知的ps和pe的马克-霍温克(mark-houwink)系数将表观单位调整为均聚聚乙烯(pe)。通过使用线性校准来确定辛烯掺入,该线性校准是通过分析已知组成的共聚物而开发的。
[0103]
symrad ht-gpc分析
[0104]
通过在混合symyx/dow构建的机器人辅助稀释高温凝胶渗透色谱仪(sym-rad-gpc)上分析来确定分子量数据。通过在160℃下加热120分钟,将聚合物样品溶解于浓度为10mg/ml的1,2,4-三氯苯(tcb)中,该浓度由300ppm的丁基羟基甲苯(bht)稳定。在注射250μl样品的等分试样之前立即将每个样品稀释到1mg/ml。gpc配备有两个聚合物实验室(polymer labs)plgel 10μm mixed-b柱(300
×
10mm),在160℃下流速为2.0ml/分钟。使用polychar ir4检测器以浓缩模式进行样品检测。采用窄聚苯乙烯(ps)标准品的常规校准,使用在此温度下tcb中ps和pe的已知马克-霍温克(mark-houwink)系数调整为均聚聚乙烯(pe)的表观单位。
[0105]
1-辛烯掺入的ir分析
[0106]
用于ht-gpc分析的样品的运行先于ir分析。对于ir分析,利用48孔ht硅晶片来沉积和分析样品的1-辛烯掺入。对于该分析,将样品加热至160℃持续小于或等于210分钟;将样品再加热以去除磁性gpc搅拌棒,并用j-kem scientific加热机械振荡器上的玻璃棒搅拌棒振荡。在使用tecan miniprep 75沉积站加热的同时沉积样品,并且在160℃下在氮气
吹扫下将1,2,4-三氯苯从沉积的晶片孔中蒸发掉。使用nexus 670e.s.p.ft-ir在ht硅晶片上进行1-辛烯的分析。
[0107]
实施例
[0108]
实施例1至90是配体结构1-43的配体中间体、配体和分离的主催化剂的合成程序。本发明金属-配体络合物1至本发明金属-配体络合物13(imlc-1至imlc-13)由各种配体1至43合成。在实施例91和92中,将imlc-1至imlc-13和原位产生的金属-配体络合物的聚合反应的结果列表并讨论。本公开的一个或多个特征根据如下实施例进行说明:
[0109]
金属-配体络合物的合成
[0110]
实施例1
–n1-己基-3-硝基苯-1,2-二胺的合成
[0111][0112]
向250ml圆底烧瓶中装入3-硝基苯-1,2-二胺(5.00g,32.65mmol)、k2co3(9.02g,65.30mmol)和dmf(80ml)。添加1-溴己烷(4.6ml,32.65mmol),并在氮气下在75℃下搅拌15小时。添加水和etoac,收集有机层,并用盐水洗涤多次。去除所有挥发物,并通过柱色谱法(100%己烷梯度至100% etoac)纯化粗产物。一些杂质残留,但被带入下一步骤。收率:7.75g,71%。
[0113]1h nmr(400mhz,cdcl3)δ7.68(dd,j=8.7,1.3hz,1h),6.86(dd,j=7.7,1.4hz,1h),6.72(dd,j=8.7,7.6hz,1h),5.97(s,2h),3.11(t,j=7.1hz,2h),1.71(dq,j=15.7,7.2,6.6hz,2h),1.54-1.42(m,2h),1.42-1.30(m,6h),0.96-0.91(m,3h)。
[0114]
13
c nmr(101mhz,cdcl3)δ138.41,136.35,133.28,117.07,117.05,115.98,45.00,31.64,29.52,26.93,22.62,14.04。
[0115]
实施例2
–
2-(3,5-二叔丁基苯基)-1-己基-4-硝基-1h-苯并[d]咪唑的合成
[0116][0117]
向20ml小瓶中装入n
1-己基-3-硝基苯-1,2-二胺(0.263g,1.11mmol)、3,5-二叔丁基苯甲醛(0.242g,1.11mmol)和etoh(7ml)。将溶液在75℃下加热过夜。去除所有挥发物,然后添加k2co3(0.337g,2.44mmol)和ch2cl2(8ml),随后添加碘(0.281g,1.11mmol)。将反应在室温下搅拌2小时。添加水,并萃取有机层(溶剂?)。去除所有挥发物,并通过柱色谱法(己烷:etoac,70:30)纯化粗产物。收率:0.483g,54%。
[0118]1h nmr(400mhz,cdcl3)δ8.18(dd,j=8.1,0.9hz,1h),7.73(dd,j=8.1,1.0hz,1h),7.62(t,j=1.9hz,1h),7.53(d,j=1.8hz,2h),7.40(t,j=8.1hz,1h),4.30-4.20(m,2h),1.86(p,j=7.5hz,2h),1.39(s,18h),1.33-1.18(m,6h),0.89-0.80(m,3h)。
[0119]
13
c nmr(101mhz,cdcl3)δ158.74,151.38,139.19,138.33,136.94,128.77,124.56,123.90,121.42,119.23,116.15,45.26,35.04,31.41,31.22,29.95,26.37,22.40,13.92。
[0120]
实施例3
–
2-(3,5-二叔丁基苯基)-1-己基-1h-苯并[d]咪唑-4-胺的合成
[0121][0122]
向100ml圆底烧瓶中装入2-(3,5-二叔丁基苯基)-1-己基-4-硝基-1h-苯并[d]咪唑(2.10g,4.82mmol)、乙醇(30ml)和饱和nh4cl水溶液(10ml)。在氮气下在室温下搅拌混合物,然后分批添加zn粉末(1.58g,24.10mmol)。通过lc-ms监测反应。搅拌2小时后,添加etoac,并将混合物经硅藻土过滤。收集有机层并通过柱色谱法(70:30己烷:etoac)纯化。收率:1.96g,92%。
[0123]1h nmr(400mhz,cdcl3)δ7.62(t,j=1.9hz,1h),7.56(d,j=2.0hz,2h),7.18(t,j=7.9hz,1h),6.87(d,j=8.1hz,1h),6.67(d,j=7.7hz,1h),5.00(s,2h),4.18(t,j=7.8hz,2h),1.90(p,j=7.5hz,2h),1.39(s,18h),1.36-1.19(m,6h),0.92-0.78(m,3h)。
[0124]
13
c nmr(101mhz,cdcl3)δ151.57,135.42,124.60,123.85,108.1,100.47,45.28,35.08,31.43,31.27,29.80,26.43,22.45,13.95。
[0125]
实施例4
–
1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺的合成
[0126][0127]
向100ml圆底烧瓶中装入1-己基-2-均三甲苯基-4-硝基-1h-苯并[d]咪唑(1.10g,3.01mmol)、乙醇(30ml)和饱和nh4cl水溶液(10ml)。在氮气下在室温下搅拌混合物,然后分批添加zn粉末(1.58g,24.10mmol)。通过lc-ms监测反应。搅拌2小时后,添加etoac,并将混合物经硅藻土过滤。收集有机层并通过柱色谱法(100% etoac)纯化。收率:0.97g,96%。
[0128]1h nmr(400mhz,cdcl3)δ7.10(t,j=7.9hz,1h),6.81(dd,j=8.1,0.9hz,1h),6.97(s,2h),6.56(dd,j=7.7,0.9hz,1h),4.43(s,2h),3.87-3.74(m,2h),2.07(s,6h),2.05(s,
3h),1.72-1.57(m,2h),1.26-1.13(m,6h),0.90-0.77(m,3h)。
[0129]
13
c nmr(101mhz,cdcl3)δ150.57,139.19,138.82,138.07,135.33,132.50,128.32,127.31,123.21,105.68,99.88,44.15,31.22,29.41,26.46,22.38,21.25,19.86,13.93。
[0130]
实施例5
–
1-己基-2-均三甲苯基-n-(2,4,6-三异丙基苯基)-1h-苯并[d]咪唑-4-胺的合成
[0131][0132]
在手套箱内,向20ml小瓶中装入2,4,6-三异丙基苯基溴(0.093g,0.33mmol)、1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺(0.100g,0.33mmol)、pd(binap)-g4(0.030g,0.03mmol)、nao
t
bu(0.072g,0.75mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。通过1h nmr发现残留了一些杂质。通过超临界co2柱纯化来纯化样品,以低收率得到纯产物。收率:0.008g,5%)。
[0133]1h nmr(400mhz,cdcl3)δ7.10(s,2h),7.01(m,3h),6.75(d,j=8.0hz,1h),6.42(s,1h),5.99(d,j=7.8hz,1h),3.91-3.78(m,2h),3.42-3.23(m,j=6.8hz,2h),2.95(h,j=6.9hz,1h),2.38(s,3h),2.14(s,6h),1.72(p,j=7.7hz,2h),1.33(d,j=6.9hz,6h),1.32-1.20(m,6h),1.17(d,j=6.9hz,12h),0.85(t,j=6.6hz,3h)。
[0134]
13
c nmr(101mhz,cdcl3)δ150.08,147.56,147.23,140.66,139.28,138.21,134.82,132.87,131.27,128.37,127.28,123.37,121.56,102.18,98.45,44.27,34.22,31.21,29.47,28.28,26.53,24.16,22.41,21.30,19.96,13.95。
[0135]
实施例6
–
3-溴-n-丁基-2-硝基苯胺的合成
[0136][0137]
向250ml圆底烧瓶中装入1-溴-3-氟-2-硝基苯(10.00g,45.45mmol)、k2co3(7.54g,54.55mmol)和乙腈(100ml)。添加n-bunh2(4.5ml,45.45mmol),并将反应在室温下搅拌2天。去除所有挥发物,并将粗产物吸收在etoac和水中。收集有机层并经na2so4干燥。过滤出固体并去除所有挥发物,得到产物,为橙色固体/油。nmr表明产物与起始材料的比率为75:25。该材料无需进一步纯化即可用于下一步骤。收率:12.20g,98%。
[0138]1h nmr(400mhz,cdcl3)δ7.15(dd,j=8.5,7.8hz,1h),6.94(dd,j=7.8,1.1hz,1h),6.76(dd,j=8.6,1.1hz,1h),5.73(s,1h),3.20(td,j=7.1,5.1hz,2h),1.66(tt,j=
8.6,6.8hz,2h),1.52-1.39(m,2h),0.98(t,j=7.3hz,3h)。
[0139]
13
c nmr(101mhz,cdcl3)δ143.83,132.99,121.39,116.29,112.38,43.23,31.00,20.14,13.76。
[0140]
实施例7
–
3-溴-n
1-丁基苯-1,2-二胺的合成
[0141][0142]
向100ml圆底烧瓶中装入3-溴-n-丁基-2-硝基苯胺(2.64g,9.67mmol)、乙醇(30ml)和饱和nh4cl水溶液(10ml)。在氮气下在室温下搅拌混合物,然后分批添加zn粉末(5.06g,77.33mmol)。通过lc-ms监测反应。搅拌2小时后,添加etoac,并将混合物经硅藻土过滤。收集有机层并通过柱色谱法(80:20己烷:etoac)纯化。收率:1.72g,73%。
[0143]1h nmr(400mhz,cdcl3)δ6.95(dd,j=8.1,1.3hz,1h),6.70(t,j=8.0hz,1h),6.65-6.58(m,1h),3.76(s,2h),3.35(s,1h),3.12(td,j=7.0,3.6hz,2h),1.68(dtd,j=8.6,7.3,5.9hz,2h),1.56-1.42(m,2h),1.00(t,j=7.3hz,3h)。
[0144]
13
c nmr(101mhz,cdcl3)δ138.89,132.35,121.60,120.82,111.23,110.41,44.14,31.71,20.41,13.95。
[0145]
实施例8
–
4-溴-1-丁基-2-(3,5-二叔丁基苯基)-1h-苯并[d]咪唑的合成
[0146][0147]
向250ml圆底烧瓶中装入3-溴-n
1-丁基苯-1,2-二胺(1.70g,6.99mmol)、3,5-二叔丁基苯甲醛(1.53g,6.99mmol)和etoh(100ml,无水)。将混合物加热至70℃持续15小时。去除所有挥发物,然后添加ch2cl2(100ml)、k2co3(2.13g,15.38mmol)和i2(1.78g,6.99mmol),并将混合物搅拌3小时。向混合物中添加水,并收集有机层。通过柱色谱法(80:20己烷:etoac,第二产物)纯化粗产物。收率:2.56g,83%。
[0148]1h nmr(400mhz,cdcl3)δ7.58(t,j=1.9hz,1h),7.49(m,3h),7.36(dd,j=8.1,0.9hz,1h),7.16(t,j=7.9hz,1h),4.18-4.08(m,2h),1.90-1.72(m,2h),1.39(s,18h),1.36-1.22(m,2h),0.86(t,j=7.4hz,3h)。
[0149]
13
c nmr(101mhz,cdcl3)δ155.69,151.08,141.82,135.93,129.40,125.21,123.96,123.90,123.30,113.31,109.29,44.90,34.99,31.95,31.43,19.97,13.54。
[0150]
实施例8
–
n-(3,5-二叔丁基苯基)-1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺的合成
[0151][0152]
在手套箱内,向20ml小瓶中装入1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺(0.060g,0.18mmol)、1-溴-3,5-二叔丁基苯(0.053g,0.20mmol)、pd(binap-g3)(0.009g,0.01mmol)、nao
t
bu(0.043g,0.45mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。通过1h nmr发现残留了一些杂质。通过超临界co2柱色谱法纯化样品,得到干净的产物。收率:0.036g,38%。
[0153]1h nmr(400mhz,cdcl3)δ7.26(d,j=1.5hz,3h),7.22(t,j=4.5hz,5h),7.10(q,j=1.6hz,1h),7.02(s,2h),6.97-6.88(m,1h),3.88(t,j=7.7hz,2h),2.40(s,3h),2.12(s,6h),1.72(h,j=6.9hz,2h),1.39(s,18h),1.34-1.17(m,6h),0.93-0.81(m,3h)。
[0154]
13
c nmr(101mhz,cdcl3)δ151.72,150.62,141.35,139.42,138.13,135.99,135.11,132.86,128.43,127.05,123.27,115.71,113.72,103.63,100.53,44.27,34.96,31.52,31.26,29.52,26.52,22.42,21.31,19.93,13.98。
[0155]
实施例9
–
1-丁基-2-(3,5-二叔丁基苯基)-n-(邻甲苯基)-1h-苯并[d]咪唑-4-胺的合成
[0156][0157]
在手套箱内,向20ml小瓶中装入4-溴-1-丁基-2-(3,5-二叔丁基苯基)-1h-苯并[d]咪唑(0.060g,0.14mmol)、甲苯胺(0.016g,0.15mmol)、pd(binap)(0.007g,0.01mmol)、nao
t
bu(0.033g,0.34mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。收率:0.064g,36%。
[0158]1h nmr(400mhz,cdcl3)δ7.60(t,j=1.8hz,1h),7.55(t,j=1.9hz,2h),7.31-7.26(m,1h),7.23(td,j=7.7,1.7hz,1h),7.17(t,j=8.0hz,1h),7.11-6.99(m,1h),6.90(ddd,j=10.6,8.0,0.9hz,2h),6.77-6.66(m,1h),4.23-4.10(m,2h),2.40(s,3h),1.90(ddt,j=9.3,7.7,3.7hz,2h),1.42(s,18h),1.40-1.34(m,2h),0.91(t,j=7.4hz,3h)。
[0159]
13
c nmr(101mhz,cdcl3)δ153.01,151.18,140.47,136.52,136.13,132.95,130.93,130.23,129.97,126.55,123.77,123.71,123.35,122.65,120.75,104.63,100.65,44.76,35.03,32.11,31.47,20.09,18.16,13.63。
[0160]
实施例10
–
1-丁基-2-(3,5-二叔丁基苯基)-n-(2,6-二异丙基苯基)-1h-苯并[d]咪唑-4-胺的合成
[0161][0162]
在手套箱内,向20ml小瓶中装入2,6-二异丙基苯胺(0.052g,0.29mmol)、4-溴-1-丁基-2-(3,5-二叔丁基苯基)-1h-苯并[d]咪唑(0.100g,0.23mmol)、pd(binap)(0.011g,0.01mmol)、nao
t
bu(0.054g,0.57mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。通过1h nmr发现残留了一些杂质。通过超临界co2柱色谱法纯化样品,得到纯产物。收率:0.056g,46%。
[0163]1h nmr(400mhz,cdcl3)δ7.60(dd,j=12.2,1.9hz,3h),7.37(dd,j=8.6,6.5hz,1h),7.30(d,j=8.3hz,2h),7.04(t,j=7.9hz,1h),6.78(d,j=8.0hz,1h),6.48(s,1h),5.97(d,j=7.8hz,1h),4.16(dt,j=10.5,7.5hz,2h),3.40(庚(hept),j=6.9hz,2h),1.94(dq,j=9.5,7.4hz,2h),1.44(s,18h),1.42-1.35(m,2h),1.20(d,j=6.9hz,12h),0.94(t,j=7.3hz,3h)。
[0164]
13
c nmr(101mhz,cdcl3)δ152.43,151.11,148.19,140.36,135.81,135.02,131.06,130.08,127.27,123.84,123.76,123.70,123.63,102.43,98.68,44.78,35.04,32.23,31.50,28.17,23.58,20.19,13.67。
[0165]
实施例11
–
n-(2,7-二叔丁基蒽-9-基)-1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺的合成
[0166][0167]
在手套箱内,向20ml小瓶中装入9-溴-2,7-二叔丁基蒽(0.121g,0.33mmol)、1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺(0.100g,0.30mmol)、pd(binap)(0.030g,0.03mmol)、nao
t
bu(0.072g,0.75mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。通过1h nmr发现残留了一些杂质。通过超临界co2柱色谱法纯化样品,得到纯产物。收率:0.027g,15%。
[0168]1h nmr(400mhz,cdcl3)δ8.36(s,1h),8.32-8.26(m,2h),8.03(d,j=8.9hz,2h),7.61(dd,j=8.9,1.9hz,2h),7.54(s,1h),7.10(s,2h),6.96(t,j=7.9hz,1h),6.86(dd,j=8.1,0.9hz,1h),6.08(dd,j=7.8,0.9hz,1h),4.02-3.90(m,2h),2.46(s,3h),2.26(s,6h),1.79(h,j=9.6,8.6hz,2h),1.39(s,18h),1.36-1.24(m,2h),0.91(t,j=6.7hz,3h)。
[0169]
13
c nmr(101mhz,cdcl3)δ150.55,147.60,140.27,139.36,138.21,134.95,133.25,132.10,130.54,129.02,128.43,128.22,127.33,124.49,123.72,123.24,118.73,104.25,99.54,44.31,35.15,31.28,30.99,29.52,26.54,22.43,21.34,19.94,13.97。
[0170]
实施例12
–
1-己基-n-(2-异丙基苯基)-2-均三甲苯基-1h-苯并[d]咪唑-4-胺的合成
[0171][0172]
在手套箱内,向20ml小瓶中装入1-溴-2-异丙基苯(0.065g,0.33mmol)、1-己基-2-均三甲苯基-1h-苯并[d]咪唑-4-胺(0.100g,0.30mmol)、pd(binap)(0.030g,0.03mmol)、nao
t
bu(0.072g,0.75mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 80:20)纯化粗产物。通过1h nmr发现残留了一些杂质。通过超临界co2柱色谱法纯化样品,得到纯产物。收率:0.112g,83%。
[0173]1h nmr(400mhz,cdcl3)δ7.60(dd,j=7.8,1.5hz,1h),7.43(dd,j=7.6,1.7hz,1h),7.27(td,j=7.5,1.9hz,1h),7.20(td,j=7.5,1.5hz,1h),7.17(d,j=7.9hz,1h),7.06(s,2h),6.92(dd,j=8.0,0.9hz,1h),6.81(s,1h),6.78(dd,j=7.9,0.9hz,1h),3.98-3.84(m,2h),3.46(庚,j=6.8hz,1h),2.43(s,3h),2.19(s,6h),1.84-1.68(m,2h),1.32(d,j=6.9hz,6h),1.29(m,4h),0.96-0.86(m,3h)。
[0174]
13
c nmr(101mhz,cdcl3)δ150.58,142.73,139.39,138.88,138.20,138.12,135.17,132.75,128.49,127.30,126.31,126.22,124.28,124.08,123.20,103.40,100.08,44.29,31.29,29.54,27.66,26.55,23.47,22.47,21.34,20.03,14.03。
[0175]
实施例13
–
4-溴-1-丁基-2-(萘-1-基)-1h-苯并[d]咪唑的合成
[0176][0177]
向100ml圆底烧瓶中装入3-溴-n
1-丁基苯-1,2-二胺(1.62g,6.66mmol)、1-萘甲醛
(0.91ml,6.66mmol)和etoh(50ml,无水)。将混合物加热至70℃持续15小时。去除所有挥发物,然后添加ch2cl2(50ml)、k2co3(2.03g,14.66mmol)和i2(1.69g,6.66mmol),并将混合物搅拌3小时。向混合物中添加水,并收集有机层。通过柱色谱法(60:40己烷:etoac,第二产物)纯化粗产物。收率:1.84g,73%。
[0178]1h nmr(400mhz,cdcl3)δ8.03(dt,j=8.3,1.2hz,1h),7.96-7.91(m,1h),7.70(dt,j=7.0,1.2hz,1h),7.60(dtd,j=7.1,4.4,3.5,2.3hz,2h),7.57-7.50(m,2h),7.47(dq,j=8.3,1.8,1.4hz,1h),7.44(dd,j=8.0,1.0hz,1h),7.23(tt,j=7.9,1.5hz,1h),3.98(t,j=7.4hz,2h),1.69-1.49(m,2h),1.19-0.99(m,2h),0.67(tt,j=7.4,1.5hz,3h)。
[0179]
13
c nmr(101mhz,cdcl3)δ153.27,142.13,135.53,133.47,132.29,130.46,128.97,128.40,127.76,127.20,126.45,125.34,124.98,123.58,113.60,109.51,109.49,44.76,31.63,19.70,13.37。
[0180]
实施例14
–
4-溴-1-丁基-2-异丙基-1h-苯并[d]咪唑的合成
[0181][0182]
向100ml圆底烧瓶中装入3-溴-n
1-丁基苯-1,2-二胺(1.50g,6.17mmol)、异丁醛(0.56ml,6.17mmol)和etoh(50ml,无水)。将混合物加热至70℃持续15小时。去除所有挥发物,然后添加ch2cl2(50ml)、k2co3(1.88g,13.57mmol)和i2(1.57g,6.17mmol),并将混合物搅拌3小时。向混合物中添加水,并收集有机层。通过柱色谱法(60:40己烷:etoac,第二产物)纯化粗产物。收率:1.55g,89%。
[0183]1h nmr(400mhz,cdcl3)δ7.39(dd,j=7.7,0.9hz,1h),7.24(dd,j=8.0,1.0hz,1h),7.06(t,j=7.9hz,1h),4.13-4.05(m,2h),3.20(庚,j=6.9hz,1h),1.76(tt,j=9.2,6.8hz,2h),1.47(d,j=6.9hz,6h),1.39(dt,j=14.8,7.4hz,4h),0.97(t,j=7.4hz,3h)。
[0184]
13
c nmr(101mhz,cdcl3)δ160.44,141.54,135.61,124.64,122.64,112.85,108.68,43.68,32.15,26.74,21.71,20.19,13.76。
[0185]
实施例15
–
4-溴-1-丁基-1,3-二氢-2h-苯并[d]咪唑-2-酮的合成
[0186][0187]
向20ml小瓶中装入3-溴-n
1-丁基苯-1,2-二胺(0.589g,2.42mmol)和thf(10ml,非无水)。添加1,1'-羰基二咪唑(0.393g,2.42mmol),并将混合物加热至55℃15小时。去除所有挥发物,并通过柱色谱法(己烷:etoac 60:40)纯化粗产物,得到纯产物。收率:0.493g,76%。
[0188]1h nmr(400mhz,cdcl3)δ9.45(s,1h),7.20(dd,j=7.9,1.2hz,1h),6.99(t,j=7.9hz,1h),6.94(dt,j=7.9,1.0hz,1h),3.90(t,j=7.2hz,2h),1.89-1.68(m,2h),1.60-1.28(m,2h),0.98(t,j=7.4hz,3h)。
[0189]
13
c nmr(101mhz,cdcl3)δ154.61,131.17,127.63,123.95,122.34,106.76,102.29,41.02,30.37,20.05,13.72。
[0190]
实施例16
–
4-溴-1-丁基-2-氯-1h-苯并[d]咪唑的合成
[0191][0192]
向20ml小瓶中装入4-溴-1-丁基-1,3-二氢-2h-苯并[d]咪唑-2-酮(0.493g,1.83mmol)和pocl3(2.05ml,21.98mmol)。将纯净的混合物在氮气下在100℃下加热过夜。将反应冷却,并添加ch2cl2(8ml),然后缓慢添加水(淬灭首先缓慢,但随时间变得非常快)。收集有机层并经na2so4干燥。过滤出固体并去除所有挥发物。nmr显示粗产物良好。不需要进一步纯化。收率:0.498g,95%。
[0193]1h nmr(400mhz,cdcl3)δ7.34(dd,j=7.8,0.9hz,1h),7.18(dd,j=8.1,0.9hz,1h),7.06(t,j=8.0hz,1h),4.08(t,j=7.3hz,2h),1.69(dq,j=9.2,7.3hz,2h),1.37-1.19(m,2h),0.86(t,j=7.4hz,3h)。
[0194]
13
c nmr(101mhz,cdcl3)δ141.07,139.59,135.04,125.90,124.23,112.02,109.06,44.91,31.18,19.82,13.55。
[0195]
实施例17
–
9-(4-溴-1-丁基-1h-苯并[d]咪唑-2-基)-3,6-二叔丁基-9h-咔唑的合成
[0196][0197]
在手套箱中,向20ml小瓶中装入nah(0.031g,1.31mmol)。将小瓶从手套箱中取出,并将3,6-二叔丁基-9h-咔唑(cbz,0.365g,1.31mmol)和4-溴-1-丁基-2-氯-1h-苯并[d]咪唑(0.365g,0.65mmol)的dmf(6ml)溶液添加到该小瓶中。在周末期间将小瓶加热至120℃。添加己烷和水,并收集有机层。去除所有挥发物,并通过柱色谱法(己烷:etoac,90:10)纯化粗产物。产物和起始物cbz几乎共洗脱。收率:0.064g,18%。
[0198]1h nmr(400mhz,cdcl3)δ8.12(dd,j=2.0,0.7hz,2h),7.59(dd,j=7.8,0.9hz,1h),7.52-7.44(m,3h),7.28(t,j=8.0hz,1h),7.26(dd,j=8.5,j=0.6hz,2h),4.08(t,j=7.1hz,2h),1.45(s,18h),1.37-1.25(m,2h),1.06-0.95(m,2h),0.61(t,j=7.4hz,3h)。
[0199]
13
c nmr(101mhz,cdcl3)δ145.48,144.43,140.93,138.96,134.79,125.79,124.34,124.22,123.88,116.40,113.82,110.25,109.61,44.63,34.81,31.95,31.12,19.56,13.20。
[0200]
实施例18
–
1-丁基-2-(3,6-二叔丁基-9h-咔唑-9-基)-n-(邻甲苯基)-1h-苯并[d]咪唑-4-胺的合成
[0201][0202]
在手套箱内,向20ml小瓶中装入邻甲苯胺(0.014g,0.13mmol)、9-(4-溴-1-丁基-1h-苯并[d]咪唑-2-基)-3,6-二叔丁基-9h-咔唑(0.064g,0.12mmol)、pd(binap)(0.006g,0.01mmol)、naotbu(0.029g,0.30mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac 90:10)纯化粗产物。通过1h nmr发现残留了一些杂质,但无论如何在ppr中测试产物。收率:0.050g,74%。
[0203]1h nmr(400mhz,cdcl3)δ8.20(d,j=1.9hz,2h),7.63-7.57(m,1h),7.54(dd,j=8.6,1.9hz,2h),7.32-7.25(m,5h),7.07(td,j=7.4,1.2hz,1h),6.99(dd,j=8.1,0.8hz,1h),6.95(dd,j=7.9,0.8hz,1h),6.69(s,1h),4.07(t,j=7.2hz,2h),2.39(s,3h),1.71-1.59(m,3h),1.53(s,18h),1.11(dq,j=9.5,7.4hz,2h),0.67(t,j=7.4hz,3h)。
[0204]
13
c nmr(101mhz,cdcl3)δ144.24,142.63,140.03,139.37,137.06,134.96,131.57,131.05,130.71,126.63,124.35,124.10,124.07,123.15,121.42,116.48,110.08,104.48,100.70,44.25,34.86,32.03,31.33,19.72,18.08,13.30。
[0205]
使用cm3液体处理器的高通量合成-实施例15至30的一般程序
[0206]
以从cm3操作开始的高通量序列提供溴化化合物和胺用于buchwald-hartwig交叉偶联反应。
[0207]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(各自作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0208]
纯化由三个过程组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱和inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。在sfc上纯化固体。
[0209]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱鉴定所需的化合物。
[0210]
实施例19
–
1-丁基-2-异丙基-n-(2-异丙基苯基)-1h-苯并[d]咪唑-4-胺
[0211][0212]
使用“cm3合成一般程序”。收率:0.096g,54%。
[0213]1h nmr(400mhz,cdcl3)δ7.57(dd,j=7.9,1.4hz,1h),7.44(dd,j=7.6,1.7hz,1h),7.26(td,j=7.6,1.8hz,1h),7.19(td,j=7.4,1.5hz,1h),7.12(t,j=7.9hz,1h),6.83(dd,j=8.0,0.9hz,1h),6.79(s,2h),6.76(dd,j=7.9,0.9hz,2h),4.22-4.08(m,2h),3.46(庚,j=6.8hz,1h),3.28(庚,j=6.9hz,1h),1.89(tt,j=9.1,6.8hz,2h),1.55(d,j=6.8hz,6h),1.55-1.45(m,4h),1.37(d,j=6.8hz,6h),1.07(t,j=7.4hz,3h)。
[0214]
13
c nmr(101mhz,cdcl3)δ157.48,142.02,139.19,137.40,135.50,132.21,126.33,126.12,123.81,123.22,122.73,103.73,99.81,43.53,32.34,27.75,26.59,23.37,22.01,20.35,13.89。
[0215]
实施例20
–
1-丁基-2-异丙基-n-(三甲基甲硅烷基甲基)-1h-苯并[d]咪唑-4-胺的合成
[0216][0217]
使用“cm3合成一般程序”。收率:0.061g,34%。
[0218]1h nmr(400mhz,cdcl3)δ7.15(t,j=7.9hz,1h),6.66(dd,j=8.1,0.9hz,1h),6.48(dd,j=7.8,0.8hz,1h),4.88(s,1h),4.14-4.02(m,2h),3.29-3.08(m,1h),2.72(s,2h),1.90-1.72(m,2h),1.47(d,j=6.8hz,6h),1.46-1.38(m,4h),1.01(t,j=7.4hz,3h),0.25(s,9h)。
[0219]
13
c nmr(101mhz,cdcl3)δ156.52,142.47,134.77,123.32,100.57,97.70,43.41,33.25,32.26,26.48,21.92,20.26,13.82,-2.37。
[0220]
实施例21
–
1-丁基-2-(萘-1-基)-n-(邻甲苯基)-1h-苯并[d]咪唑-4-胺的合成
[0221][0222]
使用“cm3合成一般程序”。收率:0.110g,51%。
[0223]1h nmr(400mhz,cdcl3)δ8.05(dt,j=8.2,1.1hz,1h),8.00-7.94(m,1h),7.76-7.70(m,2h),7.64(dd,j=8.2,7.0hz,1h),7.57(ddd,j=8.1,6.7,1.4hz,2h),7.51(ddd,j=8.2,6.8,1.4hz,1h),7.28-7.24(m,1h),7.24-7.17(m,2h),7.04(td,j=7.4,1.3hz,1h),6.95(dd,j=8.1,0.9hz,1h),6.89(dd,j=7.9,0.9hz,1h),6.73(s,1h),3.99(t,j=7.4hz,2h),2.37(s,3h),1.66(tt,j=9.0,6.8hz,2h),1.13(庚,j=7.7hz,2h),0.71(t,j=7.4hz,3h)。
[0224]
13
c nmr(101mhz,cdcl3)δ150.41,140.23,136.89,135.61,133.64,132.99,132.52,130.98,130.69,130.23,128.82,128.38,127.13,126.55,126.45,125.54,125.08,123.64,122.97,121.45,104.31,100.55,44.51,31.73,19.78,18.08,13.41。
[0225]
实施例22
–
1-丁基-n-(3,5-二叔丁基苯基)-2-异丙基-1h-苯并[d]咪唑-4-胺的合成
[0226][0227]
使用“cm3合成一般程序”。收率:0.112g,62%。
[0228]1h nmr(400mhz,cdcl3)δ7.31(d,j=1.7hz,2h),7.22-7.18(m,2h),7.16(q,j=2.3,1.7hz,1h),7.13(s,1h),6.88(h,j=4.0hz,1h),4.23-4.10(m,2h),3.28(庚,j=6.9hz,1h),1.89(tt,j=9.1,6.8hz,2h),1.55(d,j=6.9hz,6h),1.50(dd,j=8.6,6.5hz,4h),1.45(s,18h),1.07(t,j=7.4hz,3h)。
[0229]
13
c nmr(101mhz,cdcl3)δ157.54,151.64,141.55,135.82,135.56,132.40,122.78,115.71,114.21,103.80,100.14,43.51,35.00,32.35,31.61,26.55,22.06,20.33,13.89。
[0230]
实施例23
–
n-(金刚烷-1-基)-1-丁基-2-异丙基-1h-苯并[d]咪唑-4-胺的合成
[0231][0232]
使用“cm3合成一般程序”。收率:0.012g,7%。
[0233]1h nmr(400mhz,cdcl3)δ7.11-6.94(m,1h),6.69(d,j=7.9hz,1h),6.61(d,j=7.9hz,1h),4.93(br s,1h),4.10-4.00(m,2h),3.16(庚,j=6.7hz,1h),2.21-2.11(m,9h),1.84-1.71(m,8h),1.44(d,j=6.9hz,6h),1.42-1.36(m,2h),0.98(t,j=7.3hz,3h)。由于样品量少,因此无
13
c nmr数据。
[0234]
实施例24
–
1-丁基-n-环己基-2-异丙基-1h-苯并[d]咪唑-4-胺的合成
[0235][0236]
使用“cm3合成一般程序”。收率:0.085g,47%。
[0237]1h nmr(400mhz,cdcl3)δ7.12(t,j=7.9hz,1h),6.65(dd,j=8.0,0.9hz,1h),6.48-6.36(m,1h),4.89(s,1h),4.15-4.02(m,2h),3.48(t,j=9.2hz,1h),3.21(庚,j=6.9hz,1h),2.29-2.16(m,2h),1.94-1.68(m,5h),1.48(d,j=6.9hz,6h),1.47-1.28(m,6h),1.02(t,j=7.4hz,3h)。
[0238]
13
c nmr(101mhz,cdcl3)δ156.57,139.40,135.18,131.04,123.15,100.72,97.44,51.62,43.38,33.53,32.28,26.50,26.12,25.39,21.98,20.29,13.84。
[0239]
实施例25
–
1-丁基-2-异丙基-n-(2,3,5,6-四氟苯基)-1h-苯并[d]咪唑-4-胺的合成
[0240][0241]
使用“cm3合成一般程序”。收率:0.056g,31%。
[0242]1h nmr(400mhz,cdcl3)δ7.13(t,j=7.9hz,1h),6.95(dd,j=8.1,0.8hz,1h),6.87-6.75(m,2h),6.55(dt,j=7.0,3.2hz,1h),4.20-4.06(m,2h),3.31-3.17(m,j=6.8hz,1h),1.83(tt,j=9.2,6.8hz,2h),1.49(d,j=6.9hz,6h),1.48-1.39(m,2h),1.02(t,j=7.4hz,3h)。
[0243]
13
c nmr(101mhz,cdcl3)δ158.46,145.17-147.83(m),139.46-142.06(m),135.45,133.13,132.90,122.27,105.53,102.60,98.79(t,j=23.2hz),43.55,32.25,26.53,21.90,20.25,13.76。
[0244]
实施例26
–
1-丁基-2-(萘-1-基)-n-新戊基-1h-苯并[d]咪唑-4-胺的合成
[0245][0246]
使用“cm3合成一般程序”。收率:0.091g,45%。
[0247]1h nmr(400mhz,cdcl3)δ8.05(dt,j=8.2,1.1hz,1h),8.01-7.94(m,1h),7.76-7.69(m,2h),7.64(dd,j=8.2,7.0hz,1h),7.57(ddd,j=8.2,6.8,1.4hz,1h),7.50(ddd,j
=8.3,6.8,1.4hz,1h),7.27(t,j=8.0hz,1h),6.82(dd,j=8.1,0.9hz,1h),6.56(dd,j=7.9,0.8hz,1h),5.19(t,j=6.1hz,1h),3.97(t,j=7.4hz,2h),3.19(d,j=5.0hz,2h),1.79-1.53(m,2h),1.19-1.12(m,2h),1.11(s,9h),0.71(t,j=7.4hz,3h)。
[0248]
13
c nmr(101mhz,cdcl3)δ149.54,141.80,135.15,133.67,132.68,131.89,130.10,128.86,128.67,128.36,127.06,126.41,125.65,125.12,124.22,100.78,98.06,55.69,44.39,32.46,31.76,27.84,19.79,13.45。
[0249]
实施例27
–
1-丁基-2-(萘-1-基)-n-(三甲基甲硅烷基甲基)-1h-苯并[d]咪唑-4-胺的合成
[0250][0251]
使用“cm3合成一般程序”。收率:0.074g,37%。
[0252]1h nmr(400mhz,cdcl3)δ8.04(dt,j=8.2,1.1hz,1h),8.00-7.94(m,1h),7.74-7.68(m,2h),7.64(dd,j=8.2,7.0hz,1h),7.56(ddd,j=8.2,6.8,1.3hz,1h),7.49(ddd,j=8.2,6.8,1.4hz,1h),7.31(t,j=8.0hz,1h),6.84(dd,j=8.2,0.9hz,1h),6.62(dd,j=7.9,0.9hz,1h),5.02(s,1h),4.03-3.87(m,2h),2.78(s,2h),1.77-1.48(m,2h),1.18-1.06(m,2h),0.71(t,j=7.3hz,3h),0.23(s,9h)。
[0253]
13
c nmr(101mhz,cdcl3)δ149.49,143.01,135.03,133.67,132.67,131.87,130.10,128.89,128.66,128.35,127.03,126.40,125.65,125.12,124.28,100.84,98.27,44.38,33.43,31.74,19.77,13.45,-2.37。
[0254]
实施例28
–
1-丁基-n-(2-异丙基苯基)-2-(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0255][0256]
使用“cm3合成一般程序”。收率:0.084g,42%。
[0257]1h nmr(400mhz,cdcl3)δ8.08(dt,j=8.2,1.1hz,1h),8.04-7.97(m,1h),7.84-7.74(m,2h),7.68(dd,j=8.3,7.0hz,1h),7.64-7.51(m,3h),7.44(dd,j=7.6,1.7hz,1h),7.33-7.18(m,3h),6.96(dd,j=8.1,0.8hz,1h),6.83(s,1h),6.79(dd,j=7.9,0.9hz,1h),4.03(t,j=7.4hz,2h),3.47(庚,j=6.8hz,1h),1.78-1.62(m,2h),1.31(d,j=6.9hz,6h),1.17(dd,j=6.9,4.5hz,2h),0.75(t,j=7.4hz,3h)。
[0258]
13
c nmr(101mhz,cdcl3)δ150.32,143.10,138.71,138.40,135.60,133.69,
132.76,132.59,130.25,128.88,128.50,128.45,127.17,126.50,126.39,126.27,125.63,125.14,124.54,124.41,123.80,103.64,100.07,44.55,31.79,27.68,23.51,19.84,13.48。
[0259]
实施例29
–
n-(金刚烷-1-基)-1-丁基-2-(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0260][0261]
使用“cm3合成一般程序”。收率:0.063g,31%。
[0262]1h nmr(400mhz,cdcl3)δ8.03(dt,j=8.2,1.1hz,1h),7.98-7.93(m,1h),7.72-7.66(m,2h),7.62(dd,j=8.2,7.0hz,1h),7.55(ddd,j=8.2,6.8,1.3hz,1h),7.48(ddd,j=8.3,6.8,1.4hz,1h),7.19(t,j=8.0hz,1h),6.84(dd,j=8.0,0.8hz,1h),6.79(dd,j=8.1,0.8hz,1h),5.10(s,1h),3.93(t,j=7.4hz,2h),2.19(s,9h),1.77(t,j=2.6hz,6h),1.68-1.55(m,2h),1.11(h,j=7.4hz,2h),0.69(t,j=7.4hz,3h)。
[0263]
13
c nmr(101mhz,cdcl3)δ149.37,138.94,135.11,133.64,133.14,132.66,130.06,128.86,128.62,128.30,127.00,126.38,125.67,125.08,123.60,104.93,98.23,51.80,44.34,42.78,36.68,31.72,29.83,19.77,13.42。
[0264]
实施例30
–
1-丁基-n-环己基-2-(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0265][0266]
使用“cm3合成一般程序”。收率:0.054g,27%。
[0267]1h nmr(400mhz,cdcl3)δ8.03(dt,j=8.2,1.1hz,1h),7.99-7.94(m,1h),7.73-7.67(m,2h),7.62(dd,j=8.2,7.0hz,1h),7.55(ddd,j=8.2,6.8,1.4hz,1h),7.48(ddd,j=8.3,6.8,1.4hz,1h),7.24(t,j=8.0hz,1h),6.79(dd,j=8.1,0.8hz,1h),6.56-6.47(m,1h),5.03(s,1h),3.97(q,j=7.8,7.4hz,2h),3.61-3.42(m,1h),2.24(dd,j=12.5,4.0hz,2h),1.85(dp,j=10.9,3.6hz,2h),1.76-1.56(m,3h),1.54-1.22(m,5h),1.16-1.05(m,2h),0.70(t,j=7.3hz,3h)。
[0268]
13
c nmr(101mhz,cdcl3)δ149.53,139.85,135.28,133.63,132.64,131.88,130.06,128.82,128.63,128.33,127.05,126.38,125.63,125.07,124.20,101.04,97.92,51.64,44.38,33.50,31.74,26.03,25.32,19.77,13.43。
[0269]
实施例31
–
1-丁基-2-(萘-1-基)-n-(邻甲苯基)-1h-苯并[d]咪唑-4-胺的合成
[0270][0271]
使用“cm3合成一般程序”。收率:0.070g,35%。
[0272]1h nmr(400mhz,cdcl3)δ8.08(dt,j=8.3,1.1hz,1h),8.03-7.97(m,1h),7.78(td,j=7.2,1.3hz,2h),7.70-7.51(m,4h),7.34-7.23(m,3h),7.08(td,j=7.4,1.3hz,1h),6.99(ddd,j=11.0,8.0,0.9hz,2h),6.83(s,1h),4.04(t,j=7.4hz,2h),2.43(s,3h),1.76-1.63(m,2h),1.24-1.10(m,2h),0.75(t,j=7.4hz,3h)。
[0273]
13
c nmr(101mhz,cdcl3)δ150.46,140.32,136.92,135.69,133.69,133.10,132.57,131.06,130.65,130.29,128.88,128.46,128.44,127.20,126.62,126.51,125.59,125.14,123.72,123.00,121.39,104.41,100.66,44.55,31.78,19.83,18.16,13.48。
[0274]
实施例32
–
1-丁基-2-(萘-1-基)-n-(2,3,5,6-四氟苯基)-1h-苯并[d]咪唑-4-胺的合成
[0275][0276]
使用“cm3合成一般程序”。收率:0.045g,22%。
[0277]1h nmr(400mhz,cdcl3)δ8.06(dt,j=8.2,1.1hz,1h),7.98(dd,j=8.1,1.4hz,1h),7.76-7.69(m,2h),7.65(dd,j=8.2,7.0hz,1h),7.55(dddd,j=22.7,8.2,6.8,1.4hz,2h),7.31-7.25(m,1h),7.11(dd,j=8.2,0.8hz,1h),6.94(s,1h),6.84(tt,j=9.9,7.0hz,1h),6.65(dt,j=7.2,3.3hz,1h),4.02(t,j=7.4hz,2h),1.66(tdd,j=10.3,8.0,4.4hz,2h),1.12(dd,j=14.9,7.5hz,2h),0.71(t,j=7.4hz,3h)。
[0278]
13
c nmr(101mhz,cdcl3)δ151.19,135.51,133.84,133.63,133.39,132.40,130.39,128.78,128.44,128.04,127.27,126.53,125.39,125.05,123.35,105.67,103.04,99.28(t,j=23.1hz),44.61,31.73,19.77,13.39。
[0279]
实施例33
–
1-丁基-n-(3,5-二叔丁基苯基)-2-(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0280][0281]
使用“cm3合成一般程序”。收率:0.114g,57%。
[0282]
1h nmr(400mhz,cdcl3)δ8.08(dt,j=8.3,1.2hz,1h),8.02-7.97(m,1h),7.80-7.72(m,2h),7.67(dd,j=8.2,7.0hz,1h),7.56(dddd,j=21.9,8.3,6.8,1.4hz,2h),7.37-7.33(m,2h),7.32(d,j=1.8hz,3h),7.16(t,j=1.7hz,1h),7.01(p,j=4.3hz,1h),4.08-4.03(m,2h),1.78-1.63(m,2h),1.43(s,18h),1.24-1.11(m,2h),0.75(t,j=7.4hz,3h)。
[0283]
13
c nmr(101mhz,cdcl3)δ151.77,150.31,141.37,136.31,135.58,133.69,132.96,132.57,130.30,128.77,128.45,128.34,127.24,126.53,125.53,125.10,123.91,115.88,113.99,103.90,100.61,44.53,35.00,31.79,31.57,19.81,13.48。
[0284]
实施例34
–
1-丁基-n,2-二(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0285][0286]
使用“cm3合成一般程序”。收率:0.071g,31%。
[0287]1h nmr(400mhz,cdcl3)δ8.32(dq,j=7.9,0.8hz,1h),8.08(dt,j=8.3,1.1hz,1h),8.02-7.98(m,1h),7.94-7.90(m,1h),7.83-7.76(m,3h),7.71-7.65(m,2h),7.63-7.45(m,6h),7.24(t,j=8.0hz,1h),7.04-6.98(m,2h),4.09-4.02(m,2h),1.71(tt,j=9.0,6.9hz,2h),1.23-1.12(m,2h),0.75(t,j=7.4hz,3h)。
[0288]
13
c nmr(101mhz,cdcl3)δ150.58,137.93,137.43,135.69,134.82,133.69,133.14,132.56,130.33,128.87,128.70,128.47,128.37,128.35,127.25,126.54,126.15,125.97,125.63,125.55,125.14,123.77,123.56,122.81,117.69,104.89,100.83,44.58,31.78,19.83,13.48。
[0289]
实施例35
–
1-丁基-2-异丙基-n-(邻甲苯基)-1h-苯并[d]咪唑-4-胺的合成
[0290]
[0291]
使用“cm3合成一般程序”。收率:0.105g,58%。
[0292]1h nmr(400mhz,cdcl3)δ7.61(dd,j=8.0,1.3hz,1h),7.33(dd,j=7.6,1.6hz,1h),7.27(td,j=7.7,1.6hz,1h),7.16(t,j=7.9hz,1h),7.07(td,j=7.4,1.3hz,1h),6.92(dd,j=7.9,0.9hz,1h),6.87(dd,j=8.1,0.9hz,1h),6.79(s,1h),4.21-4.09(m,2h),3.27(庚,j=6.9hz,1h),2.47(s,3h),1.96-1.81(m,2h),1.55(d,j=6.9hz,6h),1.50(dt,j=14.8,7.2hz,2h),1.07(t,j=7.4hz,3h)。
[0293]
13
c nmr(101mhz,cdcl3)δ157.66,140.69,136.08,135.60,132.53,130.95,129.89,126.60,122.67,122.41,120.46,104.41,100.34,43.53,32.34,26.59,22.02,20.34,18.17,13.90。
[0294]
实施例36
–
1-丁基-n-(2,6-二异丙基苯基)-2-(萘-1-基)-1h-苯并[d]咪唑-4-胺的合成
[0295][0296]
在手套箱内,向20ml小瓶中装入2,6-二异丙基苯胺(0.105g,0.59mmol)、4-溴-1-丁基-2-(萘-1-基)-1h-苯并[d]咪唑(0.204g,0.54mmol)、pd2dba3(0.025g,0.03mmol)、pcy3(0.054ml,0.05mmol)、nao
t
bu(0.129g,1.34mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac90:10)纯化粗产物。收率:0.140g,55%。
[0297]1h nmr(400mhz,cdcl3)δ8.09(dt,j=8.2,1.1hz,1h),8.03-7.99(m,1h),7.87(dq,j=7.4,0.9hz,1h),7.83(dd,j=7.0,1.3hz,1h),7.69(dd,j=8.3,7.0hz,1h),7.64-7.53(m,2h),7.45-7.39(m,1h),7.39-7.33(m,2h),7.16(t,j=7.9hz,1h),6.90(dd,j=8.1,0.9hz,1h),6.57(s,1h),6.11(dd,j=7.9,0.9hz,1h),4.10-4.01(m,2h),3.49(庚,j=6.9hz,2h),1.81-1.69(m,2h),1.27(d,j=6.9hz,12h),1.24-1.16(m,2h),0.77(t,j=7.4hz,3h)。
[0298]
13
c nmr(101mhz,cdcl3)δ149.94,148.21,140.57,135.43,135.03,133.74,132.67,131.58,130.22,128.93,128.63,128.48,127.42,127.17,126.49,125.69,125.17,124.02,123.85,102.44,98.90,44.59,31.88,28.29,24.81,19.92,13.50。
[0299]
实施例37
–
1-丁基-n-(2,6-二异丙基苯基)-2-异丙基-1h-苯并[d]咪唑-4-胺的合成
[0300][0301]
在手套箱内,向20ml小瓶中装入2,6-二异丙基苯胺(0.071g,0.40mmol)、1-丁基-n-(2,6-二异丙基苯基)-2-异丙基-1h-苯并[d]咪唑-4-胺(0.108g,0.37mmol)、pd2dba3(0.017g,0.02mmol)、pcy3(0.037ml,0.04mmol)、nao
t
bu(0.088g,0.91mmol)和甲苯(8ml)。将小瓶加热至100℃持续6小时并通过lc-ms检查。通过lc-ms证实产物。添加水和etoac,收集有机层,并去除所有挥发物。通过柱色谱法(己烷:etoac90:10)纯化粗产物。收率:0.109g,76%。
[0302]1h nmr(400mhz,cdcl3)δ7.40(dd,j=8.8,6.4hz,1h),7.34(d,j=6.8hz,2h),7.01(t,j=7.9hz,1h),6.74(d,j=8.0hz,1h),6.49(s,1h),5.99(d,j=7.8hz,1h),4.22-4.10(m,2h),3.42(h,j=6.9hz,2h),3.31(庚,j=7.0hz,1h),1.92(tt,j=9.3,6.8hz,2h),1.58(d,j=6.9hz,6h),1.57-1.49(m,2h),1.25(d,j=6.9hz,12h),1.09(t,j=7.3hz,3h)。
[0303]
13
c nmr(101mhz,cdcl3)δ156.94,148.01,140.04,135.39,135.28,130.78,127.14,123.76,122.91,102.32,98.43,43.58,32.42,28.17,26.62,24.25,22.09,20.42,13.90。
[0304]
金属络合物合成的一般程序
[0305]
在手套箱内,在室温下在3分钟内将配体的溶液(0.5ml,c6d6)(约15mg,对于单[2,1]络合物为1当量并且对于双[2,1]金属络合物为2当量)添加到固体m(bn)4(m=zr或hf,约15mg)中。每次滴完后都要旋转小瓶以确保混合。添加后,将溶液转移到nmr管中并通过1h和
13
c nmr检查。将样品放回手套箱并除去所有挥发物。使配体和mbn4彼此接触约0.5小时。去除所有挥发物,粗产物无需进一步纯化即可用于间歇式反应器测试。根据配体:金属的比率,通过nmr证实1当量或2当量的甲苯。
[0306]
实施例38
–
本发明金属-配体络合物1(imlc 1)的合成
[0307][0308]
使用金属络合物合成的一般程序。
[0309]1h nmr(400mhz,c6d6)δ7.41-7.31(m,1h),7.19-7.07(m,6h),7.07-7.01(m,6h),
7.00(d,j=1.5hz,1h),6.88-6.80(m,3h),6.75(d,j=1.6hz,1h),6.62(d,j=1.7hz,1h),6.56-6.49(m,6h),6.45-6.39(m,1h),6.04(d,j=7.8hz,1h),3.55(庚,j=6.8hz,1h),3.40(tt,j=9.2,7.0hz,2h),2.31-2.13(m,6h),2.11(s,3h),2.03(s,3h),1.85(s,3h),1.45-1.29(m,2h),1.21(d,j=6.9hz,3h),1.15(d,j=6.8hz,3h),1.06-0.95(m,2h),0.94-0.80(m,4h),0.75(t,j=7.2hz,3h)。
[0310]
13
c nmr(101mhz,c6d6)δ151.99,147.04,147.02,145.52,144.85,141.00,138.57,138.40,138.01,137.52,132.11,131.97,129.92,129.27,129.07,128.97,128.88,128.60,128.31,128.20,127.64,126.92,126.88,126.44,126.23,125.33,124.76,124.38,121.90,105.75,98.39,84.92,44.65,30.96,29.11,27.82,26.22,24.94,23.67,22.20,20.78,20.19,19.94,13.72。
[0311]
实施例39
–
本发明金属-配体络合物2(imlc 2)的合成
[0312][0313]
使用金属络合物合成的一般程序。
[0314]1h nmr(400mhz,c6d6)δ7.70(t,j=1.8hz,1h),7.48(d,j=1.8hz,2h),7.30(d,j=1.9hz,3h),7.15-6.90(m,14h),6.79(tt,j=7.3,1.3hz,3h),6.68-6.59(m,6h),6.53(dd,j=8.1,1.5hz,1h),6.39(dd,j=8.1,0.7hz,1h),5.97(dd,j=7.9,0.7hz,1h),3.44(t,j=7.4hz,2h),3.39(q,j=6.8hz,1h),2.34(s,6h),1.36-1.23(m,2h),1.20(s,18h),1.10(d,j=6.7hz,6h),0.82(h,j=7.4hz,2h),0.51(t,j=7.3hz,3h)。
[0315]
13
c nmr(101mhz,c6d6)δ153.32,152.16,146.94,145.28,145.20,131.81,131.45,129.92,128.96,128.60,128.26,128.19,127.34,126.54,126.22,125.33,124.65,124.44,124.38,121.73,106.66,98.33,44.48,34.85,31.42,30.95,28.86,25.83,23.89,19.48,13.13。
[0316]
实施例40
–
本发明金属-配体络合物3(imlc 3)的合成
[0317][0318]
使用金属络合物合成的一般程序。
[0319]1h nmr(400mhz,c6d6)δ8.68-8.62(m,2h),8.20(s,1h),7.94(d,j=9.0hz,2h),7.51(dd,j=8.9,1.9hz,2h),7.14-7.05(m,7h),7.05-6.99(m,3h),6.98-6.92(m,3h),6.89(t,j=7.7hz,6h),6.84(t,j=8.0hz,2h),6.79(s,2h),6.76-6.68(m,3h),6.57-6.49(m,4h),6.44(d,j=8.0hz,1h),6.26-6.16(m,6h),5.92(d,j=7.7hz,1h),3.50-3.36(m,2h),2.23(s,6h),2.10(s,3h),2.06(s,6h),1.33(s,18h),1.02(q,j=7.5hz,4h),0.78-0.71(m,3h)。
[0320]
13
c nmr(101mhz,c6d6)δ152.56,148.03,146.32,145.81,141.90,141.09,138.56,138.38,132.52,131.97,131.25,129.92,129.04,129.02,128.96,128.61,128.20,127.87,127.53,126.74,125.33,124.44,124.38,124.06,121.67,118.26,106.79,99.14,88.88,83.07,44.68,34.91,30.94,29.06,26.21,22.21,20.82,19.91,13.69。
[0321]
实施例41
–
本发明金属-配体络合物4(imlc 4)的合成
[0322][0323]
使用金属络合物合成的一般程序。
[0324]1h nmr(400mhz,c6d6)δ7.46(t,j=1.8hz,1h),7.23(d,j=1.8hz,2h),7.15-7.04(m,12h),7.01(ddq,j=7.4,1.4,0.8hz,2h),6.97-6.92(m,1h),6.87-6.80(m,3h),6.68(dd,j=8.3,1.3hz,8h),6.55-6.51(m,2h),6.49(dd,j=8.1,0.7hz,1h),6.45(dd,j=7.8,0.7hz,1h),3.37(dd,j=9.0,6.5hz,2h),2.29(s,6h),1.99(s,3h),1.87(s,6h),1.36(s,18h),1.06-0.96(m,2h),0.94-0.79(m,4h),0.74(t,j=7.2hz,3h)。
[0325]
13
c nmr(101mhz,c6d6)δ152.46,152.18,148.67,147.16,144.83,140.90,138.56,138.06,137.52,133.07,131.80,129.92,128.96,128.82,128.61,128.27,128.19,127.79,126.65,125.33,124.81,124.38,122.68,121.86,118.48,105.01,98.11,85.50,44.49,
34.81,31.44,30.95,29.01,26.17,22.21,20.74,19.88,13.70。
[0326]
实施例42
–
本发明金属-配体络合物5(imlc 5)的合成
[0327][0328]
使用金属络合物合成的一般程序。
[0329]1h nmr(400mhz,c6d6)δ7.24-6.98(m,21h),6.98-6.86(m,4h),6.82-6.74(m,9h),6.63-6.57(m,1h),6.56-6.50(m,5h),6.26(d,j=8.1hz,1h),5.82(d,j=7.8hz,1h),3.44(dd,j=9.4,7.0hz,2h),3.11(庚,j=7.3hz,1h),2.45(d,j=2.3hz,6h),1.95(s,3h),1.42(p,j=7.9hz,2h),1.06(d,j=7.3hz,6h),0.98(h,j=7.4hz,2h),0.69(t,j=7.4hz,3h)。
[0330]
13
c nmr(101mhz,c6d6)δ157.14,147.47,144.90,144.78,138.57,137.53,135.46,132.65,131.04,130.60,130.57,129.93,128.97,128.77,128.60,128.35,128.20,127.36,127.11,125.87,125.76,125.33,124.38,121.74,104.47,98.00,86.14,44.56,31.56,29.17,21.08,20.15,19.81,17.42,13.30。
[0331]
实施例43
–
本发明金属-配体络合物9(imlc 9)的合成
[0332][0333]
使用金属络合物合成的一般程序。
[0334]1h nmr太复杂而不能指定。受阻旋转需要可变温度nmr。由于低信噪比,因此无
13
c nmr。
[0335]
实施例44
–
本发明金属-配体络合物6(imlc 6)的合成
[0336][0337]
使用金属络合物合成的一般程序。
[0338]1h nmr(400mhz,c6d6)δ8.38-8.27(m,2h),7.41-6.98(m,16h),6.94(q,j=7.6hz,8h),6.75(t,j=7.3hz,3h),6.63(dd,j=7.7,1.3hz,1h),6.56-6.48(m,4h),6.49-6.43(m,6h),6.03(d,j=7.9hz,1h),3.24(t,j=7.4hz,2h),2.17(s,6h),2.13(s,3h),1.30(s,9h),1.25(s,9h),1.17(dq,j=13.4,6.7,5.8hz,2h),0.70-0.55(m,2h),0.31(t,j=7.3hz,3h)。
[0339]
13
c nmr(101mhz,c6d6)δ147.61,146.45,145.45,144.12,142.01,139.48,139.28,138.54,137.48,135.35,131.82,131.24,131.03,130.56,129.87,128.92,128.90,128.56,128.29,128.15,125.88,125.28,124.95,124.33,121.93,116.95,110.02,105.28,98.25,85.10,44.10,34.44,31.83,31.76,31.59,31.48,31.43,30.98,19.27,17.61,12.72。
[0340]
实施例45
–
本发明金属-配体络合物8(imlc 8)的合成
[0341][0342]
使用金属络合物合成的一般程序。
[0343]1h nmr(400mhz,c6d6)δ7.20-6.98(m,13h),6.97-6.75(m,11h),6.25(dd,j=8.1,0.7hz,1h),5.86(dd,j=7.9,0.7hz,1h),3.50-3.40(m,2h),3.29(p,j=6.8hz,2h),3.04(p,j=7.3hz,1h),2.95-2.13(br s,6h),1.40-1.28(m,2h),1.21(d,j=6.9hz,6h),1.04(d,j=6.7hz,6h),0.96(d,j=7.3hz,6h),0.95-0.87(m,2h),0.65(t,j=7.3hz,3h)。
[0344]
13
c nmr(101mhz,c6d6)δ157.54,145.99,145.46,144.40,138.56,137.53,132.85,130.59,130.25,129.92,128.96,128.60,128.46,128.19,127.27,126.64,125.51,125.32,124.44,121.84,106.26,98.31,44.82,31.40,29.32,28.64,25.88,24.07,20.04,19.81,13.26。
[0345]
实施例46
–
本发明金属-配体络合物7(imlc 7)的合成
[0346][0347]
使用金属络合物合成的一般程序。
[0348]1h nmr(400mhz,c6d6)δ7.60(d,j=8.2hz,1h),7.53-7.44(m,2h),7.34-7.25(m,3h),7.14-6.99(m,10h),6.95(t,j=7.6hz,6h),6.81-6.72(m,3h),6.55(d,j=7.6hz,6h),6.46(d,j=8.1hz,1h),6.03(d,j=7.8hz,1h),3.65(庚,j=6.9hz,1h),3.38(ddd,j=13.8,8.0,5.5hz,1h),3.27(p,j=6.7hz,1h),3.19(dt,j=14.1,7.7hz,1h),2.26(s,6h),1.34-1.28(m,2h),1.26(d,j=6.9hz,3h),1.16(d,j=6.7hz,3h),1.11(d,j=6.8hz,3h),1.08(d,j=6.7hz,3h),0.78-0.53(m,2h),0.37(t,j=7.3hz,3h)。
[0349]
13
c nmr(101mhz,c6d6)δ151.32,146.97,145.57,145.19,144.89,137.53,133.41,132.07,131.88,131.33,129.94,128.96,128.71,128.60,128.37,128.22,128.20,127.36,126.92,126.62,126.52,125.41,125.33,125.17,124.62,124.41,124.32,121.74,106.76,98.45,44.68,31.17,28.88,28.72,26.03,25.91,24.03,23.82,19.24,12.97。
[0350]
实施例47
–
本发明金属-配体络合物10(imlc 10)的合成
[0351][0352]
使用金属络合物合成的一般程序。
[0353]1h nmr(400mhz,c6d6)δ8.31-8.18(m,1h),7.78-7.69(m,2h),7.69-7.18(m,20h),7.13-6.82(m,32h),6.79(t,j=7.2hz,6h),6.51(d,j=8.1hz,2h),6.43-6.33(m,8h),6.29(d,j=7.6hz,5h),5.93(dd,j=12.0,7.7hz,2h),3.44(tt,j=14.7,6.7hz,2h),3.26(q,j=7.0hz,4h),2.25(d,j=5.2hz,4h),2.21(s,2h),2.19(s,2h),2.13(s,2h),1.37(dddd,j=13.6,9.1,7.7,6.0hz,2h),1.29-1.13(m,2h),0.90-0.60(m,4h),0.46(t,j=7.0hz,6h)。
[0354]
13
c nmr(101mhz,c6d6)δ147.57,144.24,137.53,131.92,131.26,130.56,130.22,128.35,128.20,126.89,126.73,126.26,126.11,125.95,125.33,124.97,124.79,124.46,
124.10,122.10,121.94,105.26,104.77,97.78,76.18,75.43,72.13,44.49,31.55,31.29,21.07,19.32,13.08。
[0355]
实施例48
–
本发明金属-配体络合物11(imlc 11)的合成
[0356][0357]
使用金属络合物合成的一般程序。
[0358]1h nmr(400mhz,c6d6)δ7.91(d,j=8.3hz,1h),7.73(dd,j=8.6,4.4hz,2h),7.69-7.17(m,19h),7.13-7.08(m,6h),7.08-6.85(m,19h),6.83-6.71(m,5h),5.87(t,j=8.4hz,1h),3.43(ddd,j=13.9,7.9,5.8hz,2h),3.27(dtd,j=14.0,6.9,3.8hz,2h),2.19-2.12(m,8h),1.29(dddt,j=60.0,22.7,15.6,7.2hz,4h),0.91-0.58(m,4h),0.46(dd,j=20.0,7.3hz,6h)。
[0359]
13
c nmr(101mhz,c6d6)δ151.11,145.82,144.57,137.53,135.26,135.17,133.51,131.88,131.48,131.41,128.97,128.23,128.20,128.18,127.56,127.09,126.95,126.44,126.12,125.82,125.71,125.33,125.19,125.04,124.87,124.39,121.69,121.61,106.01,105.74,98.22,85.89,44.72,44.57,31.53,31.21,19.36,13.09。
[0360]
实施例49
–
本发明金属-配体络合物12(imlc 12)的合成
[0361][0362]
使用金属络合物合成的一般程序。
[0363]1h nmr太复杂而不能指定。受阻旋转需要可变温度nmr。
[0364]1h nmr(400mhz,c6d6)δ7.75-7.25(m,8h),7.14-6.90(m,13h),6.75(td,j=7.3,1.3hz,2h),6.60-6.42(m,5h),6.33-6.18(m,2h),3.32-3.22(m,2h),3.22-3.01(m,2h),2.25-2.12(m,2h),2.10(s,6h),1.31-1.15(m,1h),1.09-0.91(m,2h),0.72-0.46(m,3h),0.46-0.23(m,6h)。
[0365]
13
c nmr(101mhz,c6d6)δ137.53,131.97,131.53,129.82,128.96,126.95,125.32,
122.14,109.17,104.97,99.64,88.42,65.54,44.63,31.16,21.05,19.27,15.22,12.98。
[0366]
19
f nmr(376mhz,c6d6)δ-139.81,-139.84,-139.87,-139.88,-139.91,-139.93,-140.21,-141.01,-142.05,-143.40,-145.81,-147.07,-147.13,-148.89,-151.69。
[0367]
实施例50
–
本发明金属-配体络合物13(imlc 13)的合成
[0368][0369]
使用金属络合物合成的一般程序。
[0370]1h nmr太复杂而不能指定。受阻旋转需要可变温度nmr。信噪比太低而不能得到良好的
13
c nmr。
[0371]1h nmr(400mhz,c6d6)δ7.72-7.20(m,10h),7.13-6.86(m,16h),6.83
[0372]-6.32(m,12h),6.31-5.59(m,5h),3.66-3.05(m,4h),2.79-2.43(m,2h),2.40
[0373]-2.14(m,5h),2.11(s,6h),1.81-0.87(m,7h),0.84-0.52(m,4h),0.52-0.16(m,6h)。
[0374]
实施例51
–
7-溴-3,3-二甲基-2-苯基-3h-吲哚的合成
[0375][0376]
步骤1:向20ml小瓶中装入(2-溴苯基)肼-hcl(6.86g,33.7mmol)、甲苯(100ml)、net3(4.70ml,30.7mmol)、2,4-二甲基戊-3-酮(5.00g,3.7mmol)和ptsa(20mg,催化剂)。将反应加热至100℃持续15小时。添加k2co3水溶液和etoac,收集有机层并经na2so4干燥。过滤出固体并去除所有挥发物,得到黄色油。粗nmr显示期望的产物和一些起始材料。该混合物无需进一步纯化即可使用。
[0377]
步骤2:在水洗后将冰醋酸添加到来自前一步骤的粗混合物中并加热至120℃持续3小时。产物的粗lc-ms显示了fisher-吲哚产物形成得很干净。将反应冷却至室温,然后添加乙醚和水,并收集有机层。去除所有挥发物,并通过柱色谱法(80:20己烷:etoac)纯化粗产物。收率:0.45g,23%。
[0378]
1h nmr(400mhz,cdcl3)δ8.24
–
8.18(m,2h),7.59
–
7.48(m,4h),7.31
–
7.26(m,1h),7.15(dd,j=8.0,7.3hz,1h),1.62(s,6h)。
[0379]
13
c nmr(101mhz,cdcl3)δ184.24,151.47,149.30,132.94,131.19,130.93,128.64,128.61,127.16,119.96,115.03,55.33,24.73。
[0380]
实施例52
–
3-溴-n-丁基-2-硝基苯胺的合成
[0381][0382]
向250ml圆底烧瓶中装入1-溴-3-氟-2-硝基苯(10.00g,45.45mmol)、k2co3(7.54g,54.55mmol)和乙腈(100ml)。添加n-bunh2(4.5ml,45.45mmol),并将反应在室温下搅拌2天。去除所有挥发物,并将粗产物吸收在etoac和水中。收集有机层并经na2so4干燥。过滤出固体并去除所有挥发物,得到产物,为橙色固体/油。nmr表明产物与起始材料的比率为75:25。该材料无需进一步纯化即可用于下一步骤。收率:12.20g,98%。
[0383]1h nmr(400mhz,cdcl3)δ7.15(dd,j=8.5,7.8hz,1h),6.94(dd,j=7.8,1.1hz,1h),6.76(dd,j=8.6,1.1hz,1h),5.73(s,1h),3.20(td,j=7.1,5.1hz,2h),1.66(tt,j=8.6,6.8hz,2h),1.52-1.39(m,2h),0.98(t,j=7.3hz,3h)。
[0384]
13
c nmr(101mhz,cdcl3)δ143.83,132.99,121.39,116.29,112.38,43.23,31.00,20.14,13.76。
[0385]
实施例53
–
3-溴-n
1-丁基苯-1,2-二胺的合成
[0386][0387]
向100ml圆底烧瓶中装入3-溴-n-丁基-2-硝基苯胺(2.64g,9.67mmol)、乙醇(30ml)和饱和nh4cl水溶液(10ml)。在氮气下在室温下搅拌混合物,然后分批添加zn粉末(5.06g,77.33mmol)。通过lc-ms监测反应。搅拌2小时后,添加etoac,并将混合物经硅藻土过滤。收集有机层并通过柱色谱法(80:20己烷:etoac)纯化。收率:1.72g,73%。
[0388]1h nmr(400mhz,cdcl3)δ6.95(dd,j=8.1,1.3hz,1h),6.70(t,j=8.0hz,1h),6.65-6.58(m,1h),3.76(s,2h),3.35(s,1h),3.12(td,j=7.0,3.6hz,2h),1.68(dtd,j=8.6,7.3,5.9hz,2h),1.56-1.42(m,2h),1.00(t,j=7.3hz,3h)。
[0389]
13
c nmr(101mhz,cdcl3)δ138.89,132.35,121.60,120.82,111.23,110.41,44.14,31.71,20.41,13.95。
[0390]
实施例54
–
4-溴-1-丁基-2-(2-甲基苯基)-1h-苯并[d]咪唑的合成
[0391][0392]
向250ml圆底烧瓶中装入3-溴-n
1-丁基苯-1,2-二胺(2.08g,8.55mmol)、2-甲基苯甲醛(0.99ml,8.55mmol)和etoh(100ml,无水)。将混合物加热至70℃持续15小时。去除所有挥发物,然后添加ch2cl2(100ml)、k2co3(2.60g,18.8mmol)和i2(2.17g,8.55mmol),并将混合
物搅拌3小时。向混合物中添加水,并收集有机层。通过柱色谱法(60:40己烷:etoac,第二产物)纯化粗产物。收率:2.21g,75%。
[0393]1h nmr(400mhz,cdcl3):δ7.50(dd,j=7.7,0.9hz,1h),7.44
–
7.35(m,3h),7.35
–
7.29(m,2h),7.18(t,j=7.9hz,1h),4.04
–
3.93(m,2h),2.24(s,3h),1.72
–
1.58(m,2h),1.18(h,j=7.4hz,2h),0.79(t,j=7.3hz,3h)。
[0394]
13
c nmr(101mhz,cdcl3)δ154.06,141.89,138.03,135.15,130.40,130.25,129.99,129.86,125.69,125.18,123.33,113.45,109.35,44.35,31.54,19.77,19.76,13.46。
[0395]
实施例55
–
4-溴-1-丁基-2-(4-叔丁基苯基)-1h-苯并[d]咪唑的合成
[0396][0397]
向250ml圆底烧瓶中装入3-溴-n
1-丁基苯-1,2-二胺(1.00g,4.11mmol)、4-叔丁基苯甲醛(0.69ml,4.11mmol)和etoh(100ml,无水)。将混合物加热至70℃持续15小时。去除所有挥发物,然后添加ch2cl2(100ml)、k2co3(1.25g,9.05mmol)和i2(1.04g,4.11mmol),并将混合物搅拌3小时。向混合物中添加水,并收集有机层。通过柱色谱法(60:40己烷:etoac,第二产物)纯化粗产物。收率:1.11g,70%。
[0398]1h nmr(400mhz,cdcl3)δ7.59
–
7.52(m,2h),7.47
–
7.41(m,2h),7.37(dd,j=7.8,0.9hz,1h),7.24(dd,j=8.1,0.9hz,1h),7.03(t,j=7.9hz,1h),4.13
–
4.07(m,2h),1.74
–
1.59(m,2h),1.30(s,9h),1.24
–
1.10(m,2h),0.77(t,j=7.4hz,3h)。
[0399]
13
c nmr(101mhz,cdcl3)δ154.45,153.06,141.84,136.05,129.20,127.20,125.57,125.08,123.24,113.16,109.46,44.78,34.79,31.72,31.21,19.82,13.51。
[0400]
实施例56
–
4-溴-1-丁基-1,3-二氢-2h-苯并[d]咪唑-2-酮的合成
[0401][0402]
向20ml小瓶中装入3-溴-n
1-丁基苯-1,2-二胺(0.589g,2.42mmol)和thf(10ml,非无水)。添加1,1'-羰基二咪唑(0.393g,2.42mmol),并将混合物加热至55℃15小时。去除所有挥发物,并通过柱色谱法(己烷:etoac 60:40)纯化粗产物,得到纯产物。收率:0.493g,76%。
[0403]1h nmr(400mhz,cdcl3)δ9.45(s,1h),7.20(dd,j=7.9,1.2hz,1h),6.99(t,j=7.9hz,1h),6.94(dt,j=7.9,1.0hz,1h),3.90(t,j=7.2hz,2h),1.89-1.68(m,2h),1.60-1.28(m,2h),0.98(t,j=7.4hz,3h)。
[0404]
13
c nmr(101mhz,cdcl3)δ154.61,131.17,127.63,123.95,122.34,106.76,102.29,41.02,30.37,20.05,13.72。
[0405]
实施例57
–
4-溴-1-丁基-2-氯-1h-苯并[d]咪唑的合成
[0406][0407]
向20ml小瓶中装入4-溴-1-丁基-1,3-二氢-2h-苯并[d]咪唑-2-酮(0.493g,1.83mmol)和pocl3(2.05ml,21.98mmol)。将纯净的混合物在氮气下在100℃下加热过夜。将反应冷却,并添加ch2cl2(8ml),然后缓慢添加水(淬灭首先缓慢,但随时间变得非常快)。收集有机层并经na2so4干燥。过滤出固体并去除所有挥发物。nmr显示粗产物良好。不需要进一步纯化。收率:0.498g,95%。
[0408]1h nmr(400mhz,cdcl3)δ7.34(dd,j=7.8,0.9hz,1h),7.18(dd,j=8.1,0.9hz,1h),7.06(t,j=8.0hz,1h),4.08(t,j=7.3hz,2h),1.69(dq,j=9.2,7.3hz,2h),1.37-1.19(m,2h),0.86(t,j=7.4hz,3h)。
[0409]
13
c nmr(101mhz,cdcl3)δ141.07,139.59,135.04,125.90,124.23,112.02,109.06,44.91,31.18,19.82,13.55。
[0410]
实施例58
–
9-(4-溴-1-丁基-1h-苯并[d]咪唑-2-基)-3,6-二叔丁基-9h-咔唑的合成
[0411][0412]
在手套箱中,向20ml小瓶中装入nah(0.031g,1.31mmol)。将小瓶从手套箱中取出,并将3,6-二叔丁基-9h-咔唑(cbz,0.365g,1.31mmol)和4-溴-1-丁基-2-氯-1h-苯并[d]咪唑(0.365g,0.65mmol)的dmf(6ml)溶液添加到该小瓶中。在周末期间将小瓶加热至120℃。添加己烷和水,并收集有机层。去除所有挥发物,并通过柱色谱法(己烷:etoac,90:10)纯化粗产物。产物和起始物cbz几乎共洗脱。收率:0.064g,18%。
[0413]1h nmr(400mhz,cdcl3)δ8.12(dd,j=2.0,0.7hz,2h),7.59(dd,j=7.8,0.9hz,1h),7.52-7.44(m,3h),7.28(t,j=8.0hz,1h),7.26(dd,j=8.5,j=0.6hz,2h),4.08(t,j=7.1hz,2h),1.45(s,18h),1.37-1.25(m,2h),1.06-0.95(m,2h),0.61(t,j=7.4hz,3h)。
[0414]
13
c nmr(101mhz,cdcl3)δ145.48,144.43,140.93,138.96,134.79,125.79,124.34,124.22,123.88,116.40,113.82,110.25,109.61,44.63,34.81,31.95,31.12,19.56,13.20。
[0415][0416]
9-(4-溴-1-丁基-1h-苯并[d]咪唑-2-基)-3,6-二叔丁基-9h-咔唑的buckwald-hartwig偶联:
[0417]
高通量序列中的buchwald-hartwig交叉偶联反应以cm3操作开始(文库75278)。
[0418]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0419]
纯化由三个阶段组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱然后冲洗inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。将固体递送回t.paine以在sfc上纯化。
[0420]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱收集所需的化合物。
[0421]
实施例59
–
化合物1
[0422]
收率=0.114g,57%。
[0423]1h nmr(400mhz,cdcl3)δ8.16(d,j=1.9hz,2h),7.60
–
7.55(m,1h),7.51(dd,j=8.6,1.9hz,2h),7.31
–
7.19(m,5h),7.05(td,j=7.4,1.3hz,1h),6.96(dd,j=8.2,0.9hz,
1h),6.92(dd,j=7.9,0.8hz,1h),6.65(s,1h),4.04(t,j=7.2hz,2h),2.36(s,3h),1.68
–
1.58(m,2h),1.50(s,18h),1.15
–
0.99(m,2h),0.65(t,j=7.3hz,3h)。
[0424]
13
c nmr(101mhz,cdcl3)δ144.16,142.23,139.42,138.72,137.77,136.67,134.76,130.41,128.43,126.06,124.33,124.26,124.03,116.43,110.05,102.57,99.38,44.21,34.83,31.99,31.36,19.76,18.42,13.29。
[0425]
实施例60
–
化合物2
[0426]
收率=0.092g,46%。
[0427]1h nmr(400mhz,cdcl3)δ8.20
–
8.10(m,2h),7.57
–
7.49(m,2h),7.40
–
7.22(m,6h),7.11(t,j=8.0hz,1h),6.84(dd,j=8.1,0.9hz,1h),6.35(s,1h),6.03(dd,j=8.0,0.9hz,1h),4.04(t,j=7.3hz,2h),3.36(庚,j=6.8hz,2h),1.50(s,18h),1.19(d,j=6.9hz,12h),1.10(dt,j=14.4,7.2hz,2h),0.66(t,j=7.3hz,3h)。
[0428]
13
c nmr(101mhz,cdcl3)δ148.12,144.14,142.10,140.58,139.40,134.71,134.64,130.01,127.40,124.33,124.29,124.01,123.78,116.44,110.06,102.58,98.91,44.22,34.83,32.00,31.49,31.37,28.19,19.77,13.29。
[0429]
实施例61
–
化合物4
[0430]
收率=0.059g,29%。
[0431]1h nmr(400mhz,cdcl3)δ8.16(d,j=1.9hz,2h),7.57
–
7.49(m,2h),7.33
–
7.26(m,3h),7.20
–
7.11(m,4h),6.87(dd,j=8.1,0.9hz,1h),6.40(s,1h),6.06(dd,j=7.9,0.9hz,1h),4.04(t,j=7.3hz,2h),2.33(s,6h),1.70
–
1.59(m,2h),1.50(s,18h),1.17
–
1.03(m,2h),0.66(t,j=7.3hz,3h)。
[0432]
13
c nmr(101mhz,cdcl3)δ144.16,142.23,139.42,138.72,137.77,136.67,134.76,130.40,128.43,126.05,124.33,124.26,124.03,116.43,110.05,102.57,99.38,44.21,34.83,31.99,31.35,19.75,18.42,13.29。
[0433]
实施例62
–
化合物5
[0434]
收率=0.099g,49%。
[0435]1h nmr(400mhz,cdcl3)δ8.14(d,j=1.9hz,2h),7.49(dd,j=8.6,1.9hz,2h),7.33
–
7.14(m,4h),6.79(dd,j=8.2,0.8hz,1h),6.54(d,j=7.9hz,1h),5.05(s,1h),3.97(t,j=7.2hz,2h),3.14(s,2h),1.65
–
1.51(m,2h),1.49(s,18h),1.07(s m,9 2h),0.62(t,j=7.3hz,3h)。
[0436]
13
c nmr(101mhz,cdcl3)δ144.04,141.82,141.65,139.39,134.49,130.34,124.57,124.23,123.92,116.37,110.00,100.94,98.13,55.54,44.05,34.81,32.42,31.99,31.28,27.76,19.67,13.25。
[0437]
实施例63
–
化合物6
[0438]
收率=0.081g,40%。
[0439]1h nmr(400mhz,cdcl3)δ8.14(d,j=1.8hz,2h),7.49(dd,j=8.6,1.9hz,2h),7.31(d,j=8.0hz,1h),7.24
–
7.16(m,2h),6.81(dd,j=8.1,0.9hz,1h),6.59(dd,j=8.0,0.8hz,1h),4.84(s,1h),3.95(t,j=7.2hz,2h),2.73(s,2h),1.61
–
1.51(m,2h),1.49(s,18h),1.09
–
0.96(m,2h),0.61(t,j=7.4hz,3h),0.19(s,9h)。
[0440]
13
c nmr(101mhz,cdcl3)δ144.01,143.03,141.57,139.39,134.38,130.35,
124.64,124.21,123.89,116.36,110.00,100.97,98.33,44.02,34.81,33.27,31.99,31.27,19.65,13.24,-2.45。
[0441]
实施例64
–
化合物7
[0442]
收率=0.109g,55%。
[0443]1h nmr(400mhz,cdcl3)δ8.16(d,j=1.9hz,2h),7.53(ddd,j=8.6,4.9,1.7hz,3h),7.39(dd,j=7.6,1.8hz,1h),7.31
–
7.26(m,3h),7.26
–
7.16(m,3h),6.93(dd,j=8.1,0.9hz,1h),6.78
–
6.72(m,1h),6.65(s,1h),4.04(t,j=7.2hz,2h),3.36(庚,j=6.9hz,1h),1.68
–
1.58(m,2h),1.50(s,18h),1.26(d,j=6.8hz,6h),1.14
–
1.02(m,2h),0.65(t,j=7.3hz,3h)。
[0444]
13
c nmr(101mhz,cdcl3)δ144.18,143.05,142.46,139.37,138.44,138.42,134.84,131.22,126.36,126.25,124.60,124.30,124.29,124.13,124.02,116.44,110.06,103.72,100.12,44.21,34.83,31.99,31.32,27.68,23.40,19.71,13.28。
[0445]
实施例65
–
化合物8
[0446]
收率=0.027g,14%。
[0447]1h nmr(400mhz,cdcl3)δ8.17
–
8.10(m,2h),7.76(dd,j=8.6,1.2hz,1h),7.50(ddd,j=8.6,5.6,1.7hz,4h),7.42
–
7.34(m,4h),7.33
–
7.19(m,6h),7.15(td,j=7.5,1.2hz,1h),6.99(dd,j=7.7,1.2hz,1h),6.80(s,1h),4.03(t,j=7.2hz,2h),1.60(dq,j=9.4,7.4hz,2h),1.50(s,18h),1.10
–
0.96(m,2h),0.63(t,j=7.4hz,3h)。
[0448]
13
c nmr(101mhz,cdcl3)δ144.18,142.73,139.12,139.03,138.98,136.62,135.01,133.90,132.02,131.13,129.26,128.74,128.03,127.33,124.23,124.02,123.92,122.55,120.96,116.39,110.13,104.81,101.23,44.29,34.82,31.99,31.20,19.66,13.25。
[0449]
实施例66
–
化合物9
[0450]
收率=0.125g,62%。
[0451]1h nmr(400mhz,cdcl3)δ8.16(d,j=1.9hz,2h),7.51(dd,j=8.6,1.9hz,2h),7.36
–
7.22(m,4h),7.11(dd,j=8.2,0.8hz,1h),6.85(tt,j=9.9,7.0hz,1h),6.77(s,1h),6.65(dt,j=7.2,3.1hz,1h),4.09(t,j=7.2hz,2h),1.69
–
1.56(m,2h),1.13
–
1.01(m,2h),0.65(t,j=7.4hz,3h)。
[0452]
13
c nmr(101mhz,cdcl3)δ144.39,143.47,139.19,134.78,134.01,131.98,124.41,124.14,123.73,116.51,110.00,105.91,103.16,99.52,44.39,34.83,31.96,31.27,19.66,13.25。
[0453]
实施例67
–
化合物10
[0454]
收率=0.021g,11%。
[0455]1h nmr(400mhz,cdcl3)δ8.24
–
8.19(m,1h),8.17(d,j=1.9hz,2h),7.94
–
7.87(m,1h),7.72(d,j=7.4hz,1h),7.67(d,j=8.2hz,1h),7.57
–
7.43(m,5h),7.35
–
7.19(m,5h),6.99(dd,j=8.1,0.9hz,1h),6.93(dd,j=7.9,0.8hz,1h),4.08(t,j=7.2hz,2h),1.70
–
1.61(m,2h),1.50(s,18h),1.18
–
1.03(m,2h),0.67(t,j=7.3hz,3h)。
[0456]
13
c nmr(101mhz,cdcl3)δ144.28,142.78,139.35,137.63,137.56,134.93,134.75,131.59,128.75,128.35,126.14,125.90,125.72,124.37,124.11,124.09,123.82,
122.62,118.07,116.50,110.04,104.88,100.84,44.28,34.84,31.99,31.33,19.71,13.30。
[0457][0458]
7-溴-3,3-二甲基-2-苯基-3h-吲哚的buckwald-hartwig偶联:
[0459]
以从cm3操作开始的高通量序列提供溴化化合物和胺用于buchwald-hartwig交叉偶联反应。
[0460]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0461]
纯化由三个阶段组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱然后冲洗inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。将固体递送回t.paine以在sfc上纯化。
[0462]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱收集所需的化合物。
[0463]
实施例68
–
化合物11
[0464]
收率=0.115g,81%。
[0465]1h nmr(400mhz,cdcl3)δ8.31
–
8.18(m,2h),7.54(qd,j=7.8,6.8,3.8hz,3h),
7.44
–
7.26(m,3h),7.03(t,j=7.7hz,1h),6.73(d,j=7.4hz,1h),6.50(s,1h),6.17(d,j=8.1hz,1h),3.40(庚,j=6.8hz,2h),1.68(s,6h),1.24(d,j=6.9hz,12h)。
[0466]
13
c nmr(101mhz,cdcl3)δ179.68,148.31,147.93,141.05,138.69,135.21,133.93,129.99,128.61,128.07,127.31,127.07,123.82,110.10,109.43,54.32,28.29,25.00,24.02。
[0467]
实施例69
–
化合物12
[0468]
收率=0.071g,59%。
[0469]1h nmr(400mhz,cdcl3)δ8.25(dt,j=7.3,1.5hz,2h),7.85(dd,j=10.1,8.1hz,2h),7.81
–
7.73(m,2h),7.61
–
7.44(m,6h),7.44
–
7.37(m,2h),7.36
–
7.32(m,1h),7.31
–
7.25(m,1h),6.94(dd,j=7.3,1.0hz,1h),1.69(d,j=1.4hz,6h)。
[0470]
13
c nmr(101mhz,cdcl3)δ180.79,148.84,141.11,139.92,136.05,134.66,133.58,130.34,129.55,129.17,128.69,128.66,128.20,127.73,127.06,126.77,126.46,123.76,121.07,113.06,112.71,112.19,54.58,24.87。
[0471]
实施例70
–
化合物13
[0472]
收率=0.095g,46%。
[0473]1h nmr(400mhz,cdcl3)δ8.26
–
8.14(m,2h),7.57
–
7.47(m,4h),7.30(d,j=6.4hz,1h),7.23(td,j=7.7,1.6hz,1h),7.16(t,j=7.7hz,1h),7.10
–
6.98(m,2h),6.88
–
6.82(m,1h),6.80(s,1h),2.43(s,3h),1.65(s,6h)。
[0474]
13
c nmr(101mhz,cdcl3)δ180.28,148.69,140.67,140.42,137.08,133.56,130.98,130.20,129.74,128.60,128.13,126.92,126.67,122.55,119.87,112.39,111.33,54.45,24.88,18.11。
[0475]
实施例71
–
化合物14
[0476]
收率=0.086g,43%。
[0477]1h nmr(400mhz,cdcl3)δ8.22
–
8.13(m,2h),7.57
–
7.46(m,3h),7.30
–
7.24(m,1h),7.20(d,j=1.6hz,2h),7.19
–
7.15(m,1h),7.12(t,j=1.7hz,1h),7.08(s,1h),6.83(dd,j=7.3,1.0hz,1h),1.64(s,6h),1.38(s,18h)。
[0478]
13
c nmr(101mhz,cdcl3)δ180.27,151.84,148.65,141.09,140.38,136.98,133.69,130.12,128.60,128.09,127.01,116.20,114.31,111.55,111.04,54.46,34.96,31.50,24.82。
[0479]1h nmr(400mhz,cdcl3)δ8.22
–
8.13(m,2h),7.57
–
7.46(m,3h),7.30
–
7.24(m,1h),7.20(d,j=1.6hz,2h),7.19
–
7.15(m,1h),7.12(t,j=1.7hz,1h),7.08(s,1h),6.83(dd,j=7.3,1.0hz,1h),1.64(s,6h),1.38(s,18h)。
[0480]
13
c nmr(101mhz,cdcl3)δ180.27,151.84,148.65,141.09,140.38,136.98,133.69,130.12,128.60,128.09,127.01,116.20,114.31,111.55,111.04,54.46,34.96,31.50,24.82。
[0481]
实施例72
–
化合物15
[0482]
收率=0.075g,38%。
[0483]1h nmr(400mhz,cdcl3)δ8.21(dt,j=7.8,2.0hz,2h),7.52(tdd,j=7.0,4.8,1.9hz,3h),7.17(q,j=5.8hz,3h),7.03(t,j=7.7hz,1h),6.73(dt,j=7.4,1.3hz,1h),
6.48(s,1h),6.16(dd,j=8.1,1.1hz,1h),2.33(d,j=2.1hz,6h),1.65(s,6h)。
[0484]
13
c nmr(101mhz,cdcl3)δ179.84,148.45,139.22,139.06,138.05,136.54,133.81,130.00,128.57,128.46,128.07,127.06,125.95,110.05,109.76,54.27,24.94,18.54。
[0485]
实施例73
–
化合物16
[0486]
收率=0.054g,27%。
[0487]1h nmr(400mhz,cdcl3)δ8.21(dtd,j=8.5,4.3,2.5hz,2h),7.57
–
7.47(m,4h),7.39(dt,j=7.7,2.0hz,1h),7.23(tt,j=7.7,2.3hz,1h),7.14(tdd,j=8.1,5.5,2.0hz,2h),6.94(dt,j=8.2,1.4hz,1h),6.84(s,1h),6.81(ddd,j=7.3,2.1,1.0hz,1h),3.39(pd,j=6.9,6.5,1.6hz,1h),1.66(d,j=1.8hz,6h),1.35(dd,j=6.8,2.0hz,6h)。
[0488]
13
c nmr(101mhz,cdcl3)δ180.07,148.61,141.55,140.37,138.97,138.15,133.58,130.15,128.60,128.08,126.95,126.36,126.15,123.76,122.30,111.81,110.85,54.43,27.81,24.90,23.18。
[0489]
实施例74
–
化合物17
[0490]
收率=0.055g,27%。
[0491]1h nmr(400mhz,cdcl3)δ8.31
–
8.18(m,3h),7.98
–
7.86(m,1h),7.66(d,j=7.8hz,2h),7.60
–
7.45(m,6h),7.36(s,1h),7.14(dd,j=8.2,7.2hz,1h),7.06(dd,j=8.1,1.1hz,1h),6.86(dd,j=7.2,1.1hz,1h),1.68(s,6h)。
[0492]
13
c nmr(101mhz,cdcl3)δ180.45,148.69,140.74,137.92,137.70,134.78,133.57,130.24,128.63,128.52,128.47,128.16,126.94,126.16,125.97,125.75,123.38,122.34,116.85,112.65,111.47,54.52,24.90。
[0493]
实施例75
–
化合物18
[0494]
收率=0.095g,47%。
[0495]1h nmr(400mhz,cdcl3)δ8.22
–
8.13(m,2h),7.51(qq,j=4.4,2.7,1.7hz,3h),7.42
–
7.36(m,2h),7.31
–
7.25(m,3h),7.17(t,j=7.7hz,1h),7.03(s,1h),6.83(dd,j=7.3,1.1hz,1h),1.63(s,6h),1.37(d,j=1.4hz,9h)。
[0496]
13
c nmr(101mhz,cdcl3)δ180.34,148.64,144.69,140.44,139.45,136.80,133.64,130.16,128.61,128.08,126.95,126.10,119.30,111.84,111.26,54.45,34.27,31.52,24.82。
[0497]
实施例76
–
化合物19
[0498]
收率=0.015g,8%。
[0499]1h nmr(400mhz,cdcl3)δ8.26
–
8.17(m,2h),7.55
–
7.47(m,3h),7.45(d,j=8.1hz,2h),7.12(dt,j=11.2,7.9hz,2h),6.95(s,1h),6.87(dd,j=7.4,1.0hz,1h),6.45
–
6.36(m,1h),1.65(s,6h)。
[0500]
13
c nmr(101mhz,cdcl3)δ180.58,148.49,140.37,136.40,136.14,133.58,132.43,130.19,128.82,128.54,128.24,126.40,125.90,112.20,112.11,54.35,24.87。
[0501]
实施例77
–
化合物20
[0502]
收率=0.094g,47%。
[0503]1h nmr(400mhz,cdcl3)δ8.26
–
8.16(m,2h),7.86
–
7.70(m,4h),7.57
–
7.50(m,3h),
7.50
–
7.43(m,3h),7.37(ddd,j=8.1,6.8,1.2hz,1h),7.27
–
7.22(m,2h),6.91(dd,j=7.3,0.9hz,1h),1.66(s,6h)。
[0504]
13
c nmr(101mhz,cdcl3)δ180.79,148.79,141.04,139.87,135.99,134.61,133.53,130.31,129.50,129.13,128.66,128.16,127.69,127.01,126.73,126.42,123.71,121.04,113.00,112.66,112.15,54.56,24.83。
[0505]
实施例78
–
化合物21
[0506]
收率=0.025g,13%。
[0507]1h nmr(400mhz,cdcl3)δ8.23
–
8.09(m,2h),7.56
–
7.45(m,3h),7.30(d,j=8.4hz,1h),7.27
–
7.22(m,2h),7.20
–
7.09(m,2h),7.01(s,1h),6.81(dd,j=7.2,1.0hz,1h),1.73(d,j=14.3hz,4h),1.63(s,6h),1.33(d,j=2.2hz,12h)。
[0508]
13
c nmr(101mhz,cdcl3)δ180.23,148.62,145.90,140.30,139.23,138.65,137.01,133.69,130.11,128.60,128.08,127.31,126.98,117.69,117.63,111.58,110.98,54.45,35.23,34.41,33.86,31.96,31.90,24.82。
[0509][0510]
4-溴-1-丁基-2-(邻甲苯基)-1h-苯并[d]咪唑的buckwald-hartwig偶联:
[0511]
以从cm3操作开始的高通量序列提供溴化化合物和胺用于buchwald-hartwig交叉偶联反应。
[0512]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0513]
纯化由三个阶段组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。
从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱然后冲洗inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。将固体递送回t.paine以在sfc上纯化。
[0514]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱收集所需的化合物。
[0515]
实施例79
–
化合物22
[0516]
收率=0.072g,38%。
[0517]1h nmr(400mhz,cdcl3)δ7.49
–
7.31(m,4h),7.26
–
7.17(m,4h),7.09(dd,j=4.0,2.2hz,2h),6.91(dd,j=7.2,1.7hz,1h),4.00(t,j=7.4hz,2h),2.29(s,3h),1.79
–
1.65(m,2h),1.36(s,18h),1.29
–
1.17(m,2h),0.83(t,j=7.3hz,3h)。
[0518]
13
c nmr(101mhz,cdcl3)δ151.72,151.21,141.23,138.15,136.08,135.14,132.72,130.52,130.42,130.31,129.82,125.85,123.52,115.83,113.89,103.63,100.51,44.13,34.94,31.66,31.49,19.85,19.76,13.52。
[0519]
实施例80
–
化合物23
[0520]
收率=0.012g,6%。
[0521]1h nmr(400mhz,cdcl3)δ7.84
–
7.71(m,4h),7.50
–
7.42(m,4h),7.42
–
7.24(m,7h),7.00(dd,j=8.0,0.9hz,1h),4.02(t,j=7.4hz,2h),2.30(s,3h),1.80
–
1.65(m,2h),1.32
–
1.17(m,2h),0.84(t,j=7.4hz,3h)。
[0522]
13
c nmr(101mhz,cdcl3)δ151.51,139.93,138.14,135.25,135.19,134.61,130.59,130.29,129.95,129.40,129.02,127.65,126.72,126.34,125.91,123.59,123.48,121.01,112.78,105.00,101.60,44.19,31.64,19.85,19.78,13.52。
[0523]
实施例81
–
化合物24
[0524]
收率=0.095g,50%。
[0525]1h nmr(400mhz,cdcl3)δ7.49
–
7.32(m,4h),7.32
–
7.25(m,3h),7.24
–
7.12(m,3h),7.03(s,1h),6.90(dd,j=7.7,1.2hz,1h),3.99(t,j=7.4hz,2h),2.28(s,3h),1.78
–
1.63(m,2 4h),1.32(d,j=1.7hz,12h),1.28
–
1.18(m,2h),0.83(t,j=7.4hz,3h)。
[0526]
13
c nmr(101mhz,cdcl3)δ151.17,145.78,139.35,138.26,138.15,136.13,135.13,132.60,130.52,130.39,130.31,129.83,127.23,125.85,123.50,117.42,117.15,103.63,100.43,44.12,35.25,35.21,34.38,33.82,31.95,31.89,31.65,19.86,19.77,13.52。
[0527]
实施例82
–
化合物25
[0528]
收率=0.036g,19%。
[0529]1h nmr(400mhz,cdcl3)δ7.53
–
7.29(m,6h),7.25
–
7.10(m,3h),7.07(t,j=7.9hz,
1h),6.82(d,j=8.0hz,1h),6.45(s,1h),6.01(d,j=7.8hz,1h),3.99(t,j=7.4hz,2h),2.32(s,3 6h),1.82
–
1.66(m,2h),1.25(h,j=7.5hz,2h),0.84(t,j=7.4hz,3h)。
[0530]
13
c nmr(101mhz,cdcl3)δ150.91,138.43,138.20,138.08,136.58,135.07,131.68,130.59,130.50,130.42,129.74,128.40,125.88,125.80,123.54,102.25,99.29,44.14,31.69,19.91,19.83,18.42,13.53。
[0531]
实施例83
–
化合物26
[0532]
收率=0.101g,53%。
[0533]1h nmr(400mhz,cdcl3)δ7.52(dd,j=7.8,1.5hz,1h),7.48
–
7.31(m,5h),7.26
–
7.09(m,3h),6.87(dd,j=8.1,0.9hz,1h),6.73
–
6.64(m,2h),4.00(t,j=7.4hz,2h),3.39(庚,j=6.9hz,1h),2.31(s,3h),1.77
–
1.64(m,2h),1.27(d,j=6.9hz,6h),1.25
–
1.17(m,2h),0.83(t,j=7.4hz,3h)。
[0534]
13
c nmr(101mhz,cdcl3)δ151.16,142.86,138.68,138.22,138.15,135.16,132.51,130.55,130.51,130.37,129.77,126.30,126.19,125.82,124.35,124.17,123.42,103.44,100.01,44.14,31.65,27.63,23.42,19.87,19.85,13.51。
[0535]
实施例84
–
化合物27
[0536]
收率=0.099g,52%。
[0537]1h nmr(400mhz,cdcl3)δ7.76
–
7.69(m,1h),7.53
–
7.48(m,2h),7.44
–
7.26(m,10h),7.25
–
7.17(m,2h),7.12(td,j=7.5,1.2hz,1h),6.93(dd,j=6.3,2.6hz,1h),6.75(s,1h),3.98(t,j=7.4hz,2h),2.21(s,3h),1.77
–
1.62(m,2h),1.29
–
1.16(m,2h),0.82(t,j=7.4hz,3h)。
[0538]
13
c nmr(101mhz,cdcl3)δ151.23,139.20,139.11,138.25,136.35,135.36,133.67,133.30,131.12,130.55,130.28,130.19,129.69,129.32,128.67,127.95,127.28,125.70,123.25,122.34,120.95,104.51,101.09,44.11,31.65,19.86,19.79,13.51。
[0539]
实施例85
–
化合物28
[0540]
收率=0.056g,30%。
[0541]1h nmr(400mhz,cdcl3)δ7.49
–
7.31(m,6h),7.31
–
7.26(m,3h),7.19(dd,j=8.1,3.7hz,2h),7.05(s,1h),6.91(dd,j=6.4,2.6hz,1h),3.99(t,j=7.4hz,2h),2.28(s,3h),1.77
–
1.63(m,2h),1.36(s,9h),1.23(dd,j=6.6,1.8hz,2h),0.82(t,j=7.3hz,3h)。
[0542]
13
c nmr(101mhz,cdcl3)δ151.22,144.38,139.49,138.15,136.00,135.15,130.53,130.34,130.30,129.85,126.03,125.85,123.45,119.09,103.86,100.66,44.13,34.23,31.64,31.50,19.85,19.77,13.51。
[0543]
实施例86
–
化合物29
[0544]
收率=0.018g,9%。
[0545]1h nmr(400mhz,cdcl3)δ7.44(dd,j=7.8,6.4hz,4h),7.41
–
7.31(m,2h),7.13(td,j=8.0,5.2hz,2h),6.96(d,j=8.0hz,1h),6.92(s,1h),6.27(d,j=7.8hz,1h),4.00(t,j=7.4hz,2h),2.31(s,3h),1.78
–
1.65(m,2h),1.30
–
1.16(m,2h),0.83(t,j=7.3hz,3h)。
[0546]
13
c nmr(101mhz,cdcl3)δ151.54,138.22,136.48,135.45,135.19,132.61,132.60,130.51,130.41,130.39,129.78,128.81,125.92,125.77,122.87,104.73,101.65,44.17,31.66,19.88,19.85,13.51。
[0547][0548]
4-溴-1-丁基-2-(4-(叔丁基)苯基)-1h-苯并[d]咪唑的buckwald-hartwig偶联:
[0549]
以从cm3操作开始的高通量序列提供溴化化合物和胺用于buchwald-hartwig交叉偶联反应。
[0550]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0551]
纯化由三个阶段组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱然后冲洗inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。将固体递送回t.paine以在sfc上纯化。
[0552]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱收集所需的化合物。
[0553]
实施例87
–
化合物30
[0554]
收率=0.066g,55%。
[0555]1h nmr(400mhz,cdcl3)δ7.69
–
7.52(m,4h),7.25
–
7.14(m,4h),7.14
–
7.06(m,2h),
6.90(dd,j=7.4,1.5hz,1h),4.29
–
4.18(m,2h),1.94
–
1.79(m,2h),1.41(s,9h),1.37(s,18h),1.33
–
1.29(m,2h),0.92(t,j=7.3hz,3h)。
[0556]
13
c nmr(101mhz,cdcl3)δ152.77,151.85,151.68,141.30,136.10,136.02,132.84,129.01,127.95,125.78,123.56,115.81,113.99,103.71,100.53,44.65,34.94,34.87,31.98,31.50,31.27,20.00,13.62。
[0557]
实施例88
–
化合物31
[0558]
收率=0.073g,61%。
[0559]1h nmr(400mhz,cdcl3)δ7.71
–
7.53(m,4h),7.21
–
7.10(m,3h),7.04(t,j=7.9hz,1h),6.80(dd,j=8.1,0.9hz,1h),6.46(s,1h),5.98(dd,j=7.7,0.8hz,1h),4.28
–
4.15(m,2h),2.31(s,6h),1.96
–
1.82(m,2h),1.41(s,9h),1.35(dd,j=14.9,7.4hz,2h),0.93(t,j=7.4hz,3h)。
[0560]
13
c nmr(101mhz,cdcl3)δ152.65,151.54,138.36,138.08,136.61,135.99,131.74,129.09,128.39,128.08,125.87,125.72,123.62,102.27,99.30,44.69,34.85,32.04,31.28,20.07,18.43,13.64。
[0561]
实施例89
–
化合物32
[0562]
收率=0.076g,63%。
[0563]1h nmr(400mhz,cdcl3)δ7.63(ddd,j=44.8,8.4,1.5hz,4h),7.51(dd,j=7.8,1.6hz,1h),7.39(dt,j=7.6,1.6hz,1h),7.27
–
7.08(m,3h),6.89
–
6.83(m,1h),6.72(s,1h),6.68(d,j=7.8hz,1h),4.23(t,j=7.7hz,2h),3.39(庚,j=6.8hz,1h),1.97
–
1.80(m,2h),1.41(s,9h),1.35(p,j=7.5hz,2h),1.27(dd,j=6.8,1.3hz,6h),0.93(td,j=7.4,1.4hz,3h)。
[0564]
13
c nmr(101mhz,cdcl3)δ152.73,151.79,142.71,138.74,138.02,136.10,132.62,129.07,127.99,126.30,126.16,125.74,124.25,123.98,123.49,103.59,100.05,44.70,34.86,32.00,31.28,27.64,23.40,20.04,13.63。
[0565]
实施例90
–
化合物33
[0566]
收率=0.069g,58%。
[0567]
1h nmr(400mhz,cdcl3)δ7.72
–
7.65(m,2h),7.60
–
7.51(m,3h),7.27
–
7.12(m,3h),7.02(td,j=7.4,1.3hz,1h),6.93
–
6.88(m,1h),6.86(d,j=7.8hz,1h),6.70(s,1h),4.28
–
4.17(m,2h),2.38(s,3h),1.95
–
1.80(m,2h),1.41(s,9h),1.40
–
1.29(m,2h),0.92(t,j=7.4hz,3h)。
[0568]
13
c nmr(101mhz,cdcl3)δ152.78,151.94,140.35,136.58,136.17,132.96,130.94,130.34,129.07,127.93,126.56,125.77,125.76,123.40,122.74,121.00,104.38,100.63,44.70,34.87,31.98,31.28,20.02,18.10,13.62。
[0569]
实施例91
–
化合物34
[0570]
收率=0.069g,57%。
[0571]1h nmr(400mhz,cdcl3)δ7.74
–
7.52(m,4h),7.39
–
7.21(m,4h),7.02(t,j=7.9hz,1h),6.77(dd,j=8.1,0.9hz,1h),6.38(s,1h),5.94(dd,j=7.8,0.9hz,1h),4.27
–
4.16(m,2h),3.36(庚,j=6.9hz,2h),1.97
–
1.84(m,2h),1.42(s,9h),1.37(d,j=7.4hz,2h),1.17(d,j=6.9hz,12h),0.94(t,j=7.4hz,3h)。
[0572]
13
c nmr(101mhz,cdcl3)δ152.62,151.41,148.15,140.31,135.86,134.94,131.33,129.11,128.16,127.26,125.73,123.74,123.66,102.26,98.77,44.70,34.86,32.10,31.29,28.15,23.94,20.11,13.66。
[0573]
实施例92
–
化合物35
[0574]
收率=0.039g,33%。
[0575]1h nmr(400mhz,cdcl3)δ7.70
–
7.54(m,4h),7.21(t,j=8.0hz,1h),7.04(d,j=8.1hz,1h),6.89
–
6.78(m,2h),6.58(dt,j=7.2,3.2hz,1h),4.29
–
4.19(m,2h),1.86(ddt,j=9.2,7.7,3.6hz,2h),1.41(s,9h),1.35(q,j=7.5hz,2h),0.92(t,j=7.4hz,3h)。
[0576]
13
c nmr(101mhz,cdcl3)δ153.02,152.68,136.04,133.61,133.31,129.03,127.64,125.82,123.08,105.60,103.04,99.39,99.16,98.93,44.77,34.89,31.96,31.25,20.00,13.59。
[0577]
实施例93
–
化合物36
[0578]
收率=0.054g,45%。
[0579]1h nmr(400mhz,cdcl3)δ8.24(d,j=8.1hz,1h),7.90(dd,j=7.6,1.9hz,1h),7.75
–
7.43(m,10h),7.30(d,j=10.9hz,2h),7.14(td,j=7.9,2.7hz,1h),6.90(ddd,j=16.9,7.8,2.7hz,2h),4.26(t,j=7.6hz,2h),1.98
–
1.80(m,2h),1.42(s,9h),1.37(q,j=8.0,7.5hz,2h),0.94(td,j=7.3,2.7hz,3h)。
[0580]
13
c nmr(101mhz,cdcl3)δ152.83,152.08,137.92,137.17,136.17,134.75,133.04,129.07,128.62,128.34,127.93,126.08,125.95,125.80,125.59,123.44,122.67,117.56,104.77,100.80,44.73,34.88,32.00,31.28,20.03,13.64。
[0581]
实施例94
–
化合物37
[0582]
收率=0.067g,56%。
[0583]1h nmr(400mhz,cdcl3)δ7.86
–
7.65(m,6h),7.59(d,j=8.4hz,2h),7.50
–
7.42(m,3h),7.40
–
7.22(m,5h),6.98(d,j=8.0hz,1h),4.26(t,j=7.7hz,2h),1.88(p,j=7.6hz,2h),1.42(s,9h),1.38
–
1.28(m,2h),0.93(t,j=7.4hz,3h)。
[0584]
13
c nmr(101mhz,cdcl3)δ153.13,151.98,139.94,136.04,135.09,134.61,129.41,129.04,129.01,127.65,126.73,126.32,125.89,123.66,123.58,121.05,112.82,105.23,101.59,44.77,34.91,31.94,31.26,20.00,13.61。
[0585]
实施例95
–
化合物38
[0586]
收率=0.076g,63%。
[0587]1h nmr(400mhz,cdcl3)δ7.73
–
7.68(m,1h),7.62
–
7.48(m,6h),7.44
–
7.29(m,5h),7.23
–
7.08(m,3h),6.92(dd,j=7.1,1.8hz,1h),6.76(s,1h),4.25
–
4.15(m,2h),1.92
–
1.81(m,2h),1.38(s,9h),1.36
–
1.31(m,2h),0.92(t,j=7.3hz,3h)。
[0588]
13
c nmr(101mhz,cdcl3)δ152.68,151.92,139.35,139.22,136.32,136.26,133.65,133.55,131.13,129.32,128.99,128.72,127.97,127.82,127.28,125.67,123.28,122.22,120.72,105.05,101.17,44.67,34.83,31.99,31.25,20.03,13.62。
[0589][0590]
4-溴-1-丁基-2-(2,3,5,6-四氟苯基)-1h-苯并[d]咪唑的buckwald-hartwig偶联:
[0591]
以从cm3操作开始的高通量序列提供溴化化合物和胺用于buchwald-hartwig交叉偶联反应。
[0592]
提供溴化起始材料并与过量胺(2:1)反应。所有反应物/试剂在溶液(甲苯)中递送,除了叔丁醇钠和催化剂(作为固体称重)。反应用另外的反应溶剂稀释至10ml,然后反应过夜。通过uplc检查第二天的反应转化率。在95℃下反应16小时后,转化率高到足以进行纯化。
[0593]
纯化由三个阶段组成:液/液萃取,通过塞子过滤,以及超临界流体色谱法(sfc)。从手套箱中取出后,向反应小瓶中添加5ml氯仿和5ml饱和氯化钠水溶液。盖上小瓶,摇动,快速排气,然后倒入25ml biotage相分离柱中。添加另外5ml氯仿,并在重力过滤后收集有机相。将收集的物质倒入gl sciences 20ml inertsep ps-sl过滤器中并再次重力过滤。类似地用5ml氯仿洗涤一次,以冲洗相分离柱然后冲洗inertsep过滤器。用5ml乙酸乙酯进行二氧化硅垫的最终冲洗,并将收集的样品在80℃下在真空下在savant speedvac上浓缩超过10小时,该savant speedvac以5托/分钟的速度变化。将固体递送回t.paine以在sfc上纯化。
[0594]
使用1-aa5μm obd 30mm
×
150mm柱,使用co2作为移动相a和75%乙腈:25%异丙醇作为移动相b,使用制备型sfc进行纯化。使用的梯度为在10分钟内5% b至50% b,总流速为100ml/min。所使用的收集补充溶剂是乙酸乙酯,bpr压强是100bar,烘箱温度是40℃,样品浓度是50mg/ml,并且注射体积是960μl。通过质谱收集所需的化合物。
[0595]
实施例96
–
化合物39
[0596]
收率=0.013g,11%。
[0597]1h nmr(400mhz,cdcl3)δ7.49(dd,j=7.7,1.7hz,1h),7.38(ddd,j=8.8,6.2,2.7hz,1h),7.32(ddd,j=9.5,7.3,2.2hz,1h),7.26
–
7.15(m,3h),6.88(dd,j=8.1,0.9hz,1h),6.67(dd,j=7.9,0.9hz,1h),6.64(s,1h),4.08(t,j=7.4hz,2h),3.36(p,j=6.9hz,1h),1.87
–
1.71(m,2h),1.26(d,j=6.9,6 2h),0.88(t,j=7.3hz,3h)。
[0598]
13
c nmr(101mhz,cdcl3)δ143.16,138.66,138.22,135.61,133.18,126.40,126.31,126.27,124.78,124.76,124.50,108.34,108.12,103.59,99.99,99.93,44.71,31.51,27.70,23.39,19.77,13.47。
[0599]
实施例97
–
化合物40
[0600]
收率=0.019g,17%。
[0601]1h nmr(400mhz,cdcl3)δ7.39
–
7.23(m,5h),7.12
–
7.04(m,1h),6.80(dd,j=8.0,3.2hz,1h),6.34(s,1h),5.98(dd,j=7.8,3.3hz,1h),4.08(t,j=7.4hz,2h),3.32(庚,j=6.8hz,2h),1.87
–
1.74(m,2h),1.30(m,2h),1.18(d,j=6.8hz,12h),0.90(t,j=7.4hz,
3h)。
[0602]
13
c nmr(101mhz,cdcl3)δ148.06,140.65,135.48,134.53,132.07,127.46,124.94,123.81,102.54,98.82,44.75,31.55,28.56,28.18,24.19,23.35,19.85,13.49。
[0603]
实施例98
–
ppr筛选
[0604][0605]
表1.均三甲苯基或3,5-二叔丁基苯基取代的氨基-苯并咪唑配体的ppr结果。结果是两次运行的平均值。
[0606][0607][0608]
表2.萘基取代的氨基-苯并咪唑配体的ppr结果。
[0609][0610][0611]
表3.异丙基取代的氨基-苯并咪唑配体的ppr结果。
[0612][0613][0614]
表4.烷基取代的氨基-苯并咪唑配体的ppr结果。
[0615][0616]
实施例99
–
间歇式反应器筛选
[0617][0618]
表5.芳基取代的氨基-并苯咪唑配体的间歇式反应器结果
[0619][0620]
在120℃下的半间歇式反应器条件(对于一系列氨基-苯并咪唑催化剂的乙烯-辛烯共聚数据):46.3g乙烯、302g 1-辛烯、612g isopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、290psi反应器压力。在150℃下的半间歇式反应器条件(对于一系列氨基-苯并咪唑催化剂的乙烯-辛烯共聚数据):43g乙烯、301g 1-辛烯、548g isopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、327psi反应器压力。
[0621][0622]
在表6中,将由金属-配体络合物imlc-9、imlc-10、imlc-11、imlc-12和imlc-13产生的聚合和聚合物结果制表。将比较催化剂c1(comp.cat c1)在相同的条件下运行,并将comp.cat.c1的聚合结果记录在表6中。
[0623]
比较催化剂c1(comp.cat.c1)
[0624]
表6.对于一系列氨基-苯并咪唑催化剂的半间歇式反应器数据
[0625][0626]
在120℃下的半间歇式反应器条件(乙烯-辛烯共聚数据):46.3g乙烯、302g 1-辛烯、612g isopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、290psi反应器压力。在150℃下的半间歇式反应器条件(对于一系列氨基-苯并咪唑的乙烯-辛烯共聚数据):43g乙烯、301g 1-辛烯、548g isopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、327psi反应器压力。
[0627]
实施例100
–
链穿梭能力
[0628][0629][0630]
表7:对于一系列氨基-苯并咪唑催化剂的在链转移条件下的乙烯-辛烯共聚数据
[0631][0632]
在120℃下的半间歇式反应器条件:11.3g乙烯、57g 1-辛烯、557gisopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、138psi反应器压力。
[0633][0634]
表8.对于一系列氨基-苯并咪唑催化剂的在链转移条件下的乙烯-辛烯共聚数据
[0635][0636]
在120℃下的半间歇式反应器条件:11.3g乙烯、57g 1-辛烯、557gisopar e、相对于催化剂的1.2当量的ribs-2活化剂、10μmol mmao-3a、138psi反应器压力。
[0637]
表9.链转移常数(ca)、三次运行的平均pdi以及pdi的标准偏差。
[0638]
cs#pdi(平均)pdi(标准偏差)caimlc-12.30.14.7imlc-22.10.20.5imlc-32.40.51.0imlc-42.90.75.0imlc-96.00.81.2imlc-23.61.02.2imlc-72.20.14.2imlc-81.90.20.8imlc-1016.88.65.2imlc-117.22.61.7imlc-123.50.52.6imlc-136.00.40.2
[0639][0640]
表10.基于咔唑的氨基-苯并咪唑催化剂的ppr结果。
[0641]
[0642][0643]
摩尔%辛烯的负值表示信号太低并且可以被认为基本上为0。
[0644][0645]
表11.基于偕二甲基的氨基-苯并咪唑催化剂的ppr结果。
[0646][0647]
[0648][0649]
表12.基于邻-甲苯基的氨基-苯并咪唑催化剂的ppr结果
[0650]
[0651][0652][0653]
表13.基于咔唑的氨基-苯并咪唑催化剂的ppr结果。
[0654][0655][0656]
通用材料
[0657]
所有市售化学品无需进一步纯化即可使用。将在手套箱中使用的己烷、isopar e和甲苯通过溶剂纯化系统纯化,然后经分子筛干燥。
当前第1页1
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!