具有茚并二苯并杂环戊二烯结构作为部分结构的高分子量化合物及包含这些高分子量化合物的有机电致发光元件的制作方法-j9九游会真人
1.本发明涉及一种适合于有机电致发光元件(有机el元件)的高分子量化合物和包含该其的有机el元件,所述有机电致发光元件为适用于各种显示装置的自发光元件。
背景技术:
2.由于有机el元件为自发光性元件,因此比液晶元件更明亮、视觉辨认性优异、能够进行鲜明的显示,因而积极地进行了研究。
3.有机el元件具有用阳极和阴极夹持有机化合物的薄膜(有机层)的结构。作为薄膜的形成方法,大致分为真空蒸镀法和涂布法。真空蒸镀法是主要使用低分子化合物、且在真空中于基板上形成薄膜的方法,其是已经付诸实用化的技术。另一方面,涂布法是主要使用高分子化合物且通过喷墨、印刷等而使用溶液在基板上形成薄膜的方法,其是材料的使用效率高、适合于大面积化、高精细化且对于今后的大面积有机el显示器而言不可或缺的技术。
4.就使用低分子材料的真空蒸镀法而言,材料的使用效率极低,若使基板大型化,则遮蔽掩模(shadow mask)的挠度变大,难以对大型基板均匀蒸镀。另外,还存在制造成本也变高的问题。
5.另一方面,就高分子材料而言,通过使其溶解于有机溶剂并涂布该溶液,从而即使在大型基板上也能够形成均匀的膜,利用这一点,能够使用以喷墨法、印刷法为代表的涂布法。因此,能够提高材料的使用效率,能够大幅削减制作所耗费的制造成本。
6.迄今为止,对使用高分子材料的有机el元件进行了各种研究,但存在发光效率、寿命等元件特性未必充分的问题(例如,参照专利文献1~专利文献5)。
7.另外,作为迄今为止用于高分子有机el元件的代表性的空穴传输材料,已知称作tfb的芴聚合物(参照专利文献6~专利文献7)。然而,tfb由于空穴传输性不充分、且电子阻挡性不充分,因此导致电子的一部分穿过发光层,存在不能期待发光效率的提高的问题。另外,由于与邻接层的膜密接性低,因此存在不能期待元件的长寿命化的问题。
8.专利文献1:美国专利申请公开第2008/0274303号说明书
9.专利文献2:日本特开2007-119763号公报
10.专利文献3:美国专利申请公开第2010/0176377号说明书
11.专利文献4:日本特开2007-177225号公报
12.专利文献5:美国专利第7651746号说明书
13.专利文献6:国际公开第1999/054385号
14.专利文献7:国际公开第2005/059951号
技术实现要素:
15.本发明的目的在于提供空穴的注入/传输性能优异、具有电子阻挡能力、在薄膜状
态下的稳定性高的高分子材料。
16.本发明的目的在于提供具有通过上述高分子材料形成的有机层(薄膜)且发光效率高、长寿命的有机el元件。
17.本发明人等着眼于包含茚并二苯并杂环戊二烯结构的三芳基胺具有高空穴注入/传输能力,进而还能期待宽能隙化,对各种包含茚并二苯并杂环戊二烯结构的三芳基胺高分子量化合物进行了合成和研究,结果发现除了空穴注入/传输能力外还具有宽能隙且优异的耐热性和薄膜稳定性的新结构的高分子量化合物,以至于完成本发明。
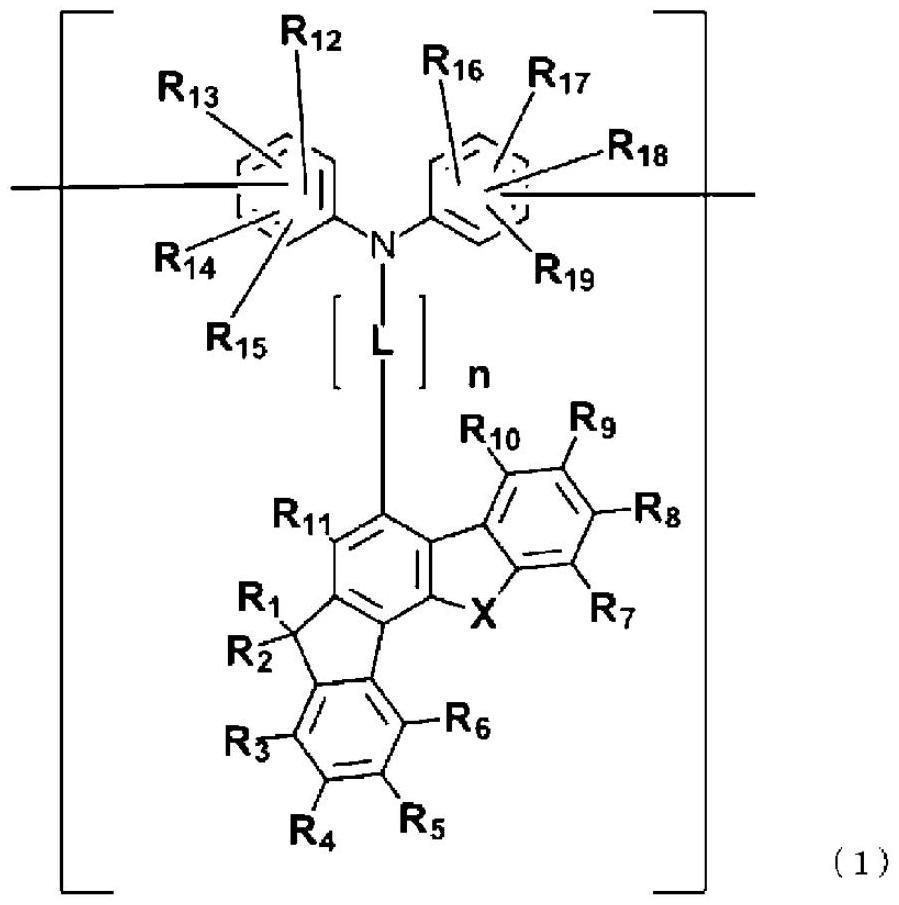
18.根据本发明,提供一种高分子量化合物,包含由下述通式(1)表示的三芳基胺结构作为重复单元。
19.根据本发明,提供一种有机el元件,具有一对电极和夹在所述一对电极之间的至少一个有机层,其特征在于,具有至少一个含有所述高分子量化合物作为构成材料的有机层。
20.本发明的有机el元件中,上述有机层适合为空穴传输层、电子阻挡层、空穴注入层或者发光层。
21.即,本发明如以下所示。
22.[1]一种高分子量化合物,包含由下述通式(1)表示的具有茚并二苯并杂环戊二烯结构作为部分结构的三芳基胺结构单元作为重复单元。
[0023]
[化学式1]
[0024][0025]
(式中,
[0026]
r1及r2分别独立地表示取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、或者取代或未取代的碳原子数为1~40的聚醚基,
[0027]
x表示氧原子或硫原子,
[0028]
r3~r
11
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳
原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、取代或未取代的芳氧基、取代或未取代的芳基、或者取代或未取代的杂芳基,
[0029]r12
及r
16
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、或者取代或未取代的芳氧基,r
12
和r
16
能够通过单键、能够具有取代基的亚甲基、氧原子或硫原子而彼此键合,
[0030]r13
~r
15
、r
17
~r
19
分别独立地表示氢原子或氘原子,
[0031]
l表示取代或未取代的碳原子数为5~40的亚芳基,
[0032]
n表示0~3的整数。)
[0033]
[2]根据[1]所述的高分子量化合物,其中,所述高分子量化合物包含由下述通式(2)表示的重复单元。
[0034]
[化学式2]
[0035][0036]
(式中,
[0037]
r1~r
19
、x,l及n与式(1)相同,
[0038]r20
~r
22
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、或者取代或未取代的芳氧基,
[0039]
y表示氢原子、氘原子、取代或未取代的氨基、取代或未取代的芳基、或者取代或未取代的杂芳基,
[0040]
m及p表示摩尔分率,
[0041]
m表示0.1~0.9,
[0042]
p表示0.1~0.9。)
[0043]
[3]根据[1]或[2]所述的高分子量化合物,其中,x为氧原子。
[0044]
[4]根据[1]~[3]中任一项所述的高分子量化合物,其中,r
12
~r
19
为氢原子。
[0045]
[5]根据[1]~[4]中任一项所述的高分子量化合物,其中,r3~r
11
为氢原子。
[0046]
[6]根据[2]~[5]中任一项所述的高分子量化合物,其中,r3~r
22
为氢原子。
[0047]
[7]根据[2]~[6]中任一项所述的高分子量化合物,其中,y为氢原子、二苯氨基、苯基、萘基、二苯并呋喃基、二苯并噻吩基、菲基、芴基、咔唑基、茚并咔唑基或吖啶基。
[0048]
[8]根据[1]~[7]中任一项所述的高分子量化合物,其中,r1及r2分别独立地为烷基、烷氧基或聚醚基。
[0049]
[9]根据[1]~[8]中任一项所述的高分子量化合物,其中,所述高分子量化合物包含热交联性结构单元作为重复单元。
[0050]
[10]根据[9]所述的高分子量化合物,其中,热交联性结构单元为选自由通式(3aa)~(3bd)组成的组中的1种以上的热交联性结构单元。
[0051]
[化学式3]
[0052][0053]
[化学式4]
[0054][0055]
(式中,
[0056]
r分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、取代或未取代的芳氧基、取代或未取代的芳基、或者取代或未取代的杂芳基,
[0057]
波浪线表示顺式或反式,
[0058]
虚线表示在主链上的键,
[0059]
a表示0~4的整数,
[0060]
b表示0~3的整数。)
[0061]
[11]一种有机电致发光元件,具有一对电极和夹在所述一对电极之间的至少一层有机层,其中,所述有机层包含[1]~[10]中任一项所述的高分子量化合物。
[0062]
[12]根据[11]所述的有机电致发光元件,其中,所述有机层为空穴传输层。
[0063]
[13]根据[11]所述的有机电致发光元件,其中,所述有机层为电子阻挡层。
[0064]
[14]根据[11]所述的有机电致发光元件,其中,所述有机层为空穴注入层。
[0065]
[15]根据[11]所述的有机电致发光元件,其中,所述有机层为发光层。
[0066]
包含由通式(1)表示的具有茚并二苯并杂环戊二烯结构作为部分结构的三芳基胺结构单元作为重复单元的高分子量化合物具有如下特性:
[0067]
(1)空穴的注入特性良好。
[0068]
(2)空穴的迁移率大。
[0069]
(3)宽能隙且电子阻挡能力优异。
[0070]
(4)薄膜状态稳定。
[0071]
(5)耐热性优异。
[0072]
在一对电极之间形成有通过这样的高分子量化合物形成的有机层、例如空穴传输层、电子阻挡层、空穴注入层或者发光层的有机el元件具有如下优点:
[0073]
(1)发光效率及电力效率高。
[0074]
(2)实用驱动电压低。
[0075]
(3)长寿命。
附图说明
[0076]
图1是示出本发明的有机el元件所具有的层结构的一例的图。
[0077]
图2是示出本发明的有机el元件所具有的层结构的一例的图。
[0078]
图3是实施例1中合成的本发明的高分子量化合物a的1h-nmr谱图。
[0079]
图4是实施例2中合成的本发明的高分子量化合物b的1h-nmr谱图。
[0080]
图5是实施例3中合成的本发明的高分子量化合物c的1h-nmr谱图。
具体实施方式
[0081]
<高分子量化合物>
[0082]
本发明的高分子量化合物是包含三芳基胺结构单元作为重复单元的高分子量化合物,所述三芳基胺结构单元具有茚并二苯并杂环戊二烯结构单元作为部分结构。
[0083]
<<三芳基胺结构单元>>
[0084]
高分子量化合物所具有的三芳基胺结构单元具有茚并二苯并杂环戊二烯结构作为部分结构,并由下述通式(1)表示。
[0085]
[化学式5]
[0086][0087]
(式中,
[0088]
r1及r2分别独立地表示取代或未取代的碳原子数为1~40的烷基、取代或未取代的
碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、或者取代或未取代的碳原子数为1~40的聚醚基,
[0089]
x表示氧原子或硫原子,
[0090]
r3~r
11
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、取代或未取代的芳氧基、取代或未取代的芳基、或者取代或未取代的杂芳基。
[0091]r12
及r
16
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、或者取代或未取代的芳氧基,r
12
和r
16
能够通过单键、能够具有取代基的亚甲基、氧原子或硫原子彼此键合,
[0092]r13
~r
15
、r
17
~r
19
分别独立地表示氢原子或氘原子,
[0093]
l表示取代或未取代的碳原子数为5~40的亚芳基,
[0094]
n表示0~3的整数。)
[0095]
作为r1及r2所示的烷基、环烷基、烷氧基、环烷氧基及聚醚基的例子,可列举以下的基团。
[0096]
烷基(碳原子数1~8);
[0097]
甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、异己基、新己基、正庚基、异庚基、新庚基、正辛基、异辛基、新辛基等。
[0098]
烷氧基(碳原子数1~8);
[0099]
甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、正戊氧基、正己氧基、正庚氧基、正辛氧基等。
[0100]
环烷基(碳原子数5~10);
[0101]
环戊基、环己基、1-金刚烷基、2-金刚烷基等。
[0102]
环烷氧基(碳原子数5~10);
[0103]
环戊氧基、环己氧基、环庚氧基、环辛氧基、1-金刚烷氧基、2-金刚烷氧基等。
[0104]
聚醚基;
[0105]
正-1,3-二氧杂丁基、正-2,4-二氧杂戊基、正-1,3,5-三氧杂己基、正-2,4,6-三氧杂庚基、正-1,3,5,7-四氧杂辛基、正-2,4,6,8-四氧杂壬烷基等。
[0106]
关于r1及r2,为了提高溶解性,适合为碳原子数1~8的烷基、烷氧基或聚醚基,就合成的方面而言,最适合为碳原子数1~8的烷基。
[0107]
x表示氧原子或硫原子,在本发明中,从空穴的注入/移动特性的观点出发,优选为氧原子。
[0108]
作为r3~r
11
所示的烷基、环烷基、烷氧基、环烷氧基及聚醚基的例子,可列举与r1及r2的说明中所示的基团相同的基团,作为烯基、芳氧基、芳基及杂芳基的例子,可列举以下的基团。
[0109]
烯基(碳原子数2~6);
[0110]
乙烯基、烯丙基、异丙烯基、2-丁烯基等。
[0111]
芳氧基;
[0112]
苯氧基、甲苯氧基、萘氧基等。
[0113]
芳基;
[0114]
苯基、萘基、蒽基、菲基、芴基、茚基、芘基、苝基、荧蒽基等。
[0115]
杂芳基;
[0116]
吡啶基、嘧啶基、三嗪基、呋喃基、吡咯基、噻吩基、喹啉基、异喹啉基、苯并呋喃基、苯并噻吩基、吲哚基、咔唑基、茚并咔唑基、苯并噁唑基、苯并噻唑基、喹噁啉基、苯并咪唑基、吡唑基、二苯并呋喃基、二苯并噻吩基、萘啶基、菲咯啉基、吖啶基、咔啉基等。
[0117]
r3~r
11
适合为芳基、氢原子或氘原子,就合成的方面而言,最适合为氢原子。
[0118]
作为r
12
及r
16
所示的烷基、聚醚基、环烷基、烷氧基、环烷氧基、烯基及芳氧基的例子,可列举与r1、r2、r3~r
11
的说明中所示的基团相同的基团。
[0119]r12
及r
16
适合为氢原子或氘原子,就合成的方面而言,最适合为氢原子。
[0120]
另外,r
13
~r
15
、r
17
~r
19
适合为氢原子或氘原子,就合成的方面而言,最适合为氢原子。
[0121]
即,r
12
~r
19
最适合为氢原子。
[0122]
另外,作为上述烷基、环烷基、烷氧基、环烷氧基、聚醚基、烯基、芳氧基、芳基及杂芳基能够具有的取代基,在氘原子、氰基、硝基等之上,还可列举以下的基团。
[0123]
卤素原子,例如,氟原子、氯原子、溴原子、碘原子;
[0124]
烷基,特别是碳原子数为1~8的烷基,例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、异己基、新己基、正庚基、异庚基、新庚基、正辛基、异辛基、新辛基;
[0125]
烷氧基,特别是碳原子数为1~8的烷氧基,例如,甲氧基、乙氧基、丙氧基;
[0126]
烯基,例如,乙烯基、烯丙基;
[0127]
芳氧基,例如,苯氧基、甲苯氧基、萘氧基;
[0128]
芳基,例如,苯基、联苯基、三联苯基、萘基、蒽基、菲基、芴基、茚基、芘基、苝基、荧蒽基、苯并菲基;
[0129]
杂芳基,例如,吡啶基、嘧啶基、三嗪基、噻吩基、呋喃基、吡咯基、喹啉基、异喹啉基、苯并呋喃基、苯并噻吩基、吲哚基、咔唑基、茚并咔唑基、苯并噁唑基、苯并噻唑基、喹噁啉基、苯并咪唑基、吡唑基、二苯并呋喃基、二苯并噻吩基、咔啉基;
[0130]
芳基乙烯基,例如,苯基乙烯基、萘基乙烯基;
[0131]
酰基,例如,乙酰基、苯甲酰基等。
[0132]
另外,这些取代基可以进一步具有上述例示的取代基。
[0133]
进而,这些取代基优选分别独立地存在,但也可以使这些取代基彼此通过单键、能够具有取代基的亚甲基、氧原子或硫原子彼此键合而形成环。
[0134]
例如,上述的芳基、杂芳基可以具有苯基作为取代基,该苯基可以进一步具有苯基作为取代基。即,若举芳基为例,则该芳基可以为联苯基、三联苯基、苯并菲基。
[0135]
l表示2价的亚芳基,作为亚芳基的例子,可列举以下的基团。
[0136]
亚芳基;
[0137]
亚苯基、亚萘基、亚菲基、亚芴基、亚茚基、亚芘基等。
[0138]
在本发明中,从空穴的注入/移动特性的观点出发,l优选为亚苯基。
[0139]
从合成的观点出发,n优选为0~2的整数,更优选为0或1。
[0140]
另外,l可以具有取代基。作为取代基,在氘原子、氰基、硝基等之上,还可列举以下的基团。
[0141]
卤素原子,例如,氟原子、氯原子、溴原子、碘原子;
[0142]
烷基,特别是碳原子数为1~8的烷基,例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、异己基、新己基、正庚基、异庚基、新庚基、正辛基、异辛基、新辛基;
[0143]
烷氧基,特别是碳原子数为1~8的烷氧基,例如,甲基氧基、乙基氧基、丙基氧基;
[0144]
烯基,例如,乙烯基、烯丙基;
[0145]
芳氧基,例如,苯氧基、甲苯氧基、萘氧基;
[0146]
芳基,例如,苯基、联苯基、三联苯基、萘基、蒽基、菲基、芴基、茚基、芘基、苝基、荧蒽基、苯并菲基;
[0147]
杂芳基,例如,吡啶基、嘧啶基、三嗪基、噻吩基、呋喃基、吡咯基、喹啉基、异喹啉基、苯并呋喃基、苯并噻吩基、吲哚基、咔唑基、茚并咔唑基、苯并噁唑基、苯并噻唑基、喹噁啉基、苯并咪唑基、吡唑基、二苯并呋喃基、二苯并噻吩基、咔啉基;
[0148]
芳基乙烯基,例如,苯基乙烯基、萘基乙烯基;
[0149]
酰基,例如,乙酰基、苯甲酰基等。
[0150]
另外,这些取代基可以进一步具有上述例示的取代基。进而,这些取代基优选分别独立地存在,但也可以使这些取代基彼此通过单键、能够具有取代基的亚甲基、氧原子或硫原子彼此键合而形成环。
[0151]
<<平均分子量>>
[0152]
关于包含由上述通式(1)表示的三芳基胺结构单元作为重复单元的本发明的高分子量化合物,如已描述那样,空穴的注入特性、空穴的迁移率、电子阻挡能力、薄膜稳定性、耐热性等特性优异,但是,从进一步提高这些特性且确保成膜性的观点出发,例如,利用gpc测得的以聚苯乙烯换算的重均分子量优选为10,000以上且小于1,000,000的范围,更优选为10,000以上且小于500,000的范围,进一步优选为10,000以上且小于200,000的范围。
[0153]
<<其它结构单元>>
[0154]
就本发明的高分子量化合物而言,为了确保例如通过涂布而应用于有机el元件中的有机层的形成时的涂布性、与其它层的密接性、耐久性,优选为包含其它结构单元作为重复单元的共聚物。作为这样的其它结构单元,可列举例如热交联性结构单元、与由上述通式(1)表示的三芳基胺结构单元不同的三芳基胺结构单元以及由下述通式(4)所示的连结结构单元等。
[0155]
<<<连结结构单元>>>
[0156]
本发明的高分子量化合物可以包含由下述通式(4)表示的连结结构单元作为重复单元。
[0157]
[化学式6]
[0158][0159]
(式中,
[0160]r20
~r
22
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、或者取代或未取代的芳氧基,
[0161]
y表示氢原子、氘原子、取代或未取代的氨基、取代或未取代的芳基、或者取代或未取代的杂芳基。)
[0162]
作为r
20
~r
22
所示的烷基、聚醚基、环烷基、烷氧基、环烷氧基、烯基及芳氧基的例子,可列举与r1、r2、r3~r
11
的说明中所示的基团相同的基团。
[0163]r20
~r
22
适合为氢原子或氘原子,就合成的方面而言,最适合为氢原子。
[0164]
作为y所示的芳基及杂芳基的例子,可列举与上述的r3~r
11
中所示的芳基及杂芳基的例子相同的基团。
[0165]
另外,y所示的氨基、芳基及杂芳基可以具有与上述的l相同的取代基。这些取代基可以进一步具有与上述的l相同的取代基。
[0166]
y优选为氢原子、二苯氨基、苯基、萘基、二苯并呋喃基、二苯并噻吩基、菲基、芴基、咔唑基、茚并咔唑基或吖啶基。
[0167]
以下,以化学式(4aa)~(4bp)示出连结结构单元的具体例。需要说明的是,在化学式(4aa)~(4bp)中,虚线表示向邻接的结构单元的键合臂,自环延伸的前端为游离的实线表示该游离的前端为甲基。虽然示出了作为连结结构单元而优选的具体例,但是本发明中所使用的连结结构单元并不限定于这些结构单元。
[0168]
[化学式7]
[0169][0170]
[化学式8]
[0171][0172]
<<<热交联性结构单元>>>
[0173]
热交联性结构单元为在结构单元中具有乙烯基、环丁烷环等反应性官能团的结构单元。本发明的高分子量化合物可以包含2种以上的热交联性结构单元作为重复单元。以式(3aa)~(3bd)示出热交联性结构单元的具体例。它们是作为热交联性结构单元而优选的具
体例,但是本发明中所使用的热交联性结构单元并不限定于这些结构单元。
[0174]
[化学式9]
[0175][0176]
[化学式10]
[0177][0178]
(式中,
[0179]
r分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、取代或未取代的芳氧基、取代或未取代的芳基、或者取代或未取代的杂芳基,
[0180]
波浪线表示顺式或反式,
[0181]
虚线表示在主链上的键,
[0182]
a表示0~4的整数,
[0183]
b表示0~3的整数。)
[0184]
需要说明的是,在上述式(3aa)~(3bd)中,虚线表示向邻接的结构单元上的键合臂,波浪线表示顺式或反式,自环延伸的前端为游离的实线表示该前端为甲基。
[0185]
作为r所示的烷基、聚醚基、环烷基、烷氧基、环烷氧基、烯基、芳氧基、芳基及杂芳基的例子,可列举与上述通式(1)中的r1、r2、r3~r
11
的说明中所示的基团相同的基团。
[0186]
r适合为氢原子或氘原子,就合成的方面而言,最适合为氢原子。
[0187]
<<结构单元的组合>>
[0188]
热交联性结构单元及与由上述通式(1)表示的三芳基胺结构单元不同的三芳基胺结构单元等其它结构单元可以单独作为重复单元包含在高分子量化合物中,也可以与由上述通式(4)表示的连结结构单元一起构成重复单元而包含在高分子量化合物中。
[0189]
在本发明的高分子量化合物中,当用a来表示由通式(1)表示的结构单元、用b来表
示由通式(4)表示的连结结构单元、用c来表示热交联性结构单元或与由通式(1)表示的三芳基胺结构单元不同的三芳基胺结构单元时,优选包含1mοl%以上、特别是20mοl%以上的结构单元a,在以这样的量包含结构单元a的条件下,优选以1mοl%以上、特别是30mοl%~70mοl%的量包含结构单元b、进而以1mοl%以上、特别是3mοl%~20mοl%的量包含结构单元c,就形成有机el元件的有机层的方面而言,最适合为包含结构单元a、结构单元b及结构单元c的三元共聚物以满足这样的条件。
[0190]
作为结构单元,优选包含结构单元a及结构单元b,特别优选包含由下述通式(2)表示的重复单元。
[0191]
[化学式11]
[0192][0193]
(式中,
[0194]
r1~r
19
、x、l及n与通式(1)相同,
[0195]r20
~r
22
分别独立地表示氢原子、氘原子、氰基、硝基、卤素原子、取代或未取代的碳原子数为1~40的烷基、取代或未取代的碳原子数为1~40的聚醚基、取代或未取代的碳原子数为3~40的环烷基、取代或未取代的碳原子数为1~40的烷氧基、取代或未取代的碳原子数为3~40的环烷氧基、取代或未取代的碳原子数为2~40的烯基、或者取代或未取代的芳氧基,
[0196]
y表示氢原子、氘原子、取代或未取代的氨基、取代或未取代的芳基、或者取代或未取代的杂芳基,
[0197]
m及p表示摩尔分率,
[0198]
m表示0.1~0.9,
[0199]
p表示0.1~0.9。)
[0200]
通式(2)中的烷基、聚醚基、环烷基、烷氧基、环烷氧基、烯基、芳氧基、芳基、杂芳基及取代基与上述的通式(1)相同。
[0201]
<<合成方法>>
[0202]
本发明的高分子量化合物可以通过如下方式来合成:通过铃木聚合反应或
hartwig-buchwald聚合反应,分别形成c-c键或c-n键而链接各结构单元。具体而言,准备具有各结构单元的单元化合物,将该单元化合物适宜地硼酸酯化或卤化,使用适宜的催化剂进行缩聚反应,由此可以合成合成高分子量化合物。
[0203]
例如,作为用于引入通式(1)的结构单元的化合物,可以使用由下述通式(1a)表示的三芳基胺衍生物。
[0204]
[化学式12]
[0205][0206]
(式中,
[0207]
q为氢原子、卤素原子或硼酸酯基,
[0208]
r1~r
19
、l、n均与通式(1)所示的r1~r
19
、l、n相同。)
[0209]
即,在上述通式(1a)中,q为氢原子的三芳基胺衍生物是用于引入通式(1)的结构单元的单元化合物,q为卤素原子或硼酸酯基的三芳基胺衍生物分别是为了合成聚合物而使用的卤化物或硼酸酯化物。上述卤化物优选为溴化物。
[0210]
例如,包含40mol%的由通式(1)表示的结构单元a、50mol%的由通式(4)表示的结构单元b、10mol%的热交联性结构单元c(式3的式(3ai))的共聚物以下面所示的通式(5)来表示。
[0211]
[化学式13]
[0212][0213]
这样的共聚物可以通过硼酸酯化体与卤化体的缩聚反应来合成,但是需要的是:用于引入结构单元a和结构单元c的中间体是硼酸酯化体,相对于此,用于引入结构单元b的
中间体为卤化体;或者用于引入结构单元a和结构单元c的中间体为卤化体,相对于此,用于引入结构单元b的中间体为硼酸酯化体。即,卤化体和硼酸酯化体的摩尔比率应该相等。
[0214]
使上述的本发明的高分子量化合物溶解于苯、甲苯、二甲苯、苯甲醚等芳香族系有机溶剂而制备涂布液,将该涂布液涂布于规定的基材上,进行加热干燥,由此可以形成空穴注入性、空穴传输性、电子阻挡性等特性优异的薄膜。所得的薄膜的耐热性也良好,而且,与其它层的密接性也良好。
[0215]
本发明的高分子量化合物能够作为有机el元件的空穴注入层和/或空穴传输层的构成材料来使用。通过上述高分子量化合物形成的空穴注入层及空穴传输层与由以往的材料形成的空穴注入层及空穴传输层相比,能够实现如下优点:空穴的注入性高,迁移率大,电子阻挡性高,能够封闭在发光层内生成的激发子,进而可提高空穴与电子再结合的概率而获得高发光效率,并且驱动电压降低,有机el元件的耐久性提高。
[0216]
另外,具有如上所述的电气特性的本发明的高分子量化合物与以往的材料相比为更宽能隙,对封闭激发子更有效,因此当然也可以适合用于电子阻挡层、发光层。
[0217]
<有机el元件>
[0218]
具备使用上述的本发明的高分子量化合物而形成的有机层的本发明的有机el元件具有例如图1所示的结构。即,在玻璃基板1(可以是透明树脂基板等透明基板)上设有透明阳极2、空穴注入层3、空穴传输层4、发光层5、电子传输层6及阴极7。
[0219]
当然,应用上述高分子量化合物的有机el元件并不限定于上述的层结构,可以在发光层5与电子传输层6之间设置空穴阻挡层,另外,如图2所示的结构那样,可以在空穴传输层11与发光层13之间设置电子阻挡层等,进而,虽然在图2中未示出,但是也可以在阴极15与电子传输层14之间设置电子注入层。进而,也可以省略若干层。例如,也可以设为在图1所示的结构中省略空穴注入层3而在玻璃基板1上设有阳极2、空穴传输层4、发光层5、电子传输层6及阴极7的简单的层结构。另外,也可设为将具有同一功能的层重叠的2层结构。
[0220]
上述高分子量化合物可有效利用其空穴注入性或空穴传输性等特性而适合用作设置于上述的阳极2与阴极7之间的有机层(例如,空穴注入层3、空穴传输层4、发光层5或电子阻挡层)的形成材料。
[0221]
在上述的有机el元件中,透明阳极2可由其本身公知的电极材料形成,可通过将如ito、金之类的功函数大的电极材料蒸镀于玻璃基板1(可以为透明树脂基板等透明基板)上来形成。
[0222]
另外,设置于透明阳极2上的空穴注入层3可以使用使本发明的高分子量化合物溶解于例如甲苯、二甲苯、苯甲醚等芳香族系有机溶剂中而成的涂布液来形成。即,可以通过将该涂布液利用旋涂、喷墨等方式涂布于透明阳极2上来形成空穴注入层3。
[0223]
另外,在具备使用上述高分子量化合物而形成的有机层的有机el元件中,上述的空穴注入层3也可以不使用上述高分子量化合物而使用以往公知的材料、例如以下的材料来形成:
[0224]
以铜酞菁为代表的卟啉化合物;
[0225]
星爆(star burst)型的三苯基胺衍生物;
[0226]
具有以单键或不包含杂原子的2价基团链接而成的结构的芳基胺(例如,三苯胺三聚物及四聚物);
[0227]
六氰基氮杂苯并菲之类的受体性杂环化合物;
[0228]
涂布型的高分子材料,例如聚(3,4-乙撑二氧噻吩)(pedot)、聚(苯乙烯磺酸酯)(pss)等。
[0229]
使用这些材料的空穴注入层3(薄膜)的形成可以根据膜形成材料的种类而通过蒸镀以及基于旋涂及喷墨等的涂布来进行。薄膜的形成与其它层也同样,可以根据膜形成材料的种类而通过蒸镀或涂布来进行。
[0230]
设置于上述的空穴注入层3上的空穴传输层4也与空穴注入层3同样,可以通过使用本发明的高分子量化合物的基于旋涂及喷墨等的涂布来形成。
[0231]
另外,在具备使用上述高分子量化合物而形成的有机层的本发明的有机el元件中,也可以使用以往公知的空穴传输材料来形成空穴传输层4。作为这样的空穴传输材料而具代表性的化合物如下所示:
[0232]
联苯胺衍生物,例如,
[0233]
n,n
’‑
二苯基-n,n
’‑
二(间-甲苯基)联苯胺(以下,简称为tpd)、
[0234]
n,n
’‑
二苯基-n,n
’‑
二(α-萘基)联苯胺(以下,简称为npd)、
[0235]
n,n,n’,n
’‑
四联苯基联苯胺;
[0236]
胺系衍生物,例如,
[0237]
1,1-双[4-(二-4-甲苯基氨基)苯基]环己烷(以下,简称为tapc)、各种三苯胺三聚物及四聚物;
[0238]
还用作空穴注入层用的涂布型高分子材料等。
[0239]
上述的空穴传输层4中使用的化合物包含上述高分子量化合物,可以分别单独成膜,也可以混合2种以上来成膜。另外,也可以使用上述化合物中的1种或多种而形成多层、将层叠这样的层而成的多层膜设为空穴传输层4。
[0240]
另外,在具备使用上述高分子量化合物而形成的有机层的有机el元件中,也可设为兼作空穴注入层3和空穴传输层4的层,这样的空穴注入/传输层可以使用pedot等高分子材料而通过涂布来形成。
[0241]
需要说明的是,在空穴传输层4(空穴注入层3也同样)中,也可以使用对该层中通常使用的材料经p掺杂三溴苯基胺六氯锑及轴烯衍生物(例如,参照wo2014/009310)等而得的材料。另外,可以使用具有tpd基本骨架的高分子化合物等来形成空穴传输层4(空穴注入层3也同样)。
[0242]
进而,电子阻挡层12(如图2那样,可以设置在空穴传输层11与发光层13之间)也可以使用本发明的高分子量化合物而通过基于旋涂或喷墨等的涂布来形成。
[0243]
另外,在具备使用上述高分子量化合物而形成的有机层的有机el元件中,也可以使用具有电子阻挡作用的公知的电子阻挡性化合物、例如咔唑衍生物、具有三苯基甲硅烷基且具有三芳基胺结构的化合物等来形成电子阻挡层12。咔唑衍生物及具有三芳基胺结构的化合物的具体例如以下所示。
[0244]
咔唑衍生物的例子:
[0245]
4,4’,4
”‑
三(n-咔唑基)三苯基胺(以下,简称为tcta);
[0246]
9,9-双[4-(咔唑-9-基)苯基]芴;
[0247]
1,3-双(咔唑-9-基)苯(以下,简称为mcp);
[0248]
2,2-双(4-咔唑-9-苯基)金刚烷(以下,简称为ad-cz)。
[0249]
具有三芳基胺结构的化合物的例子:
[0250]
9-[4-(咔唑-9-基)苯基]-9-[4-(三苯基甲硅烷基)苯基]-9h-芴。
[0251]
电子阻挡层12中使用的化合物也包含本发明的高分子量化合物,可以分别单独成膜,也可以混合2种以上来成膜。另外,也可以使用上述化合物中的1种或多种而形成多层、将层叠这样的层而成的多层膜设为电子阻挡层12。
[0252]
在具备使用上述高分子量化合物而形成的有机层的有机el元件中,发光层5可以使用以alq3为代表的羟基喹啉衍生物的金属络合物以及锌、铍及铝等的各种金属络合物、蒽衍生物、双苯乙烯基苯衍生物、芘衍生物、噁唑衍生物及聚对亚苯基亚乙烯基衍生物等发光材料来形成。
[0253]
另外,也可以由主体材料和掺杂材料构成发光层5。作为此时的主体材料,除上述的发光材料外,还可以使用噻唑衍生物、苯并咪唑衍生物及聚二烷基芴衍生物等,进而,也可以使用上述的本发明的高分子量化合物。作为掺杂剂材料,可以使用喹吖啶酮、香豆素、红荧烯、苝及它们的衍生物、苯并吡喃衍生物、罗丹明衍生物、氨基苯乙烯衍生物等。
[0254]
发光层5中使用的化合物也包含本发明的高分子量化合物,可以分别单独成膜,也可以混合2种以上来成膜。另外,也可以使用上述化合物中的1种或多种而形成多层、将层叠这样的层而成的多层膜设为发光层5。
[0255]
进而,也可以使用磷光发光材料作为发光材料来形成发光层5。作为磷光发光材料,可以使用铱、铂等的金属络合物的磷光发光体。可以使用例如:ir(ppy)3等绿色磷光发光体;firpic、fir6等蓝色磷光发光体;btp2ir(acac)等红色磷光发光体等,这些磷光发光材料可掺杂于空穴注入/传输性的主体材料、电子传输性的主体材料中来使用。
[0256]
需要说明的是,为了避免浓度猝灭,磷光性发光材料在主体材料中的掺杂优选以相对于发光层整体为1重量%~30重量%的范围通过共蒸镀来进行。
[0257]
另外,也可以使用pic-trz、cc2ta、pxz-trz、4czipn等的cdcb衍生物等的放射延迟荧光的材料作为发光材料(参照appl.phys.let.,98,083302(2011))。
[0258]
使上述高分子量化合物中承载称为掺杂剂的荧光发光体或磷光发光体、或者放射延迟荧光的材料来形成发光层5,由此可以实现驱动电压降低、发光效率得到改善的有机el元件。
[0259]
在具备使用上述高分子量化合物而形成的有机层的有机el元件中,作为空穴注入/传输性的主体材料,可以使用本发明的高分子量化合物。此外,也可以使用4,4
’‑
二(n-咔唑基)联苯(以后,简称为cbp)、tcta及mcp等的咔唑衍生物等。
[0260]
另外,在具备使用上述高分子量化合物而形成的有机层的有机el元件中,作为电子传输性的主体材料,可以使用对双(三苯基甲硅烷基)苯(以后,简称为ugh2)及2,2’,2
”‑
(1,3,5-亚苯基)-三(1-苯基-1h-苯并咪唑)(以后,简称为tpbi)等。
[0261]
在具备使用上述高分子量化合物而形成的有机层的有机el元件中,作为设置于发光层5与电子传输层6之间的空穴阻止层(未图示),可以使用其本身具有公知的空穴阻止作用的化合物来形成。作为这样的具有空穴阻止作用的公知化合物的例子,可列举以下的化合物:
[0262]
浴铜灵(以后,简称为bcp)等菲咯啉衍生物;
[0263]
铝(iii)双(2-甲基-8-喹啉)-4-苯基苯酚(以后,简称为balq)等喹啉酚衍生物的金属络合物;
[0264]
各种稀土络合物;
[0265]
三唑衍生物;
[0266]
三嗪衍生物;
[0267]
噁二唑衍生物等。
[0268]
这些材料也可以用于以下所述的电子传输层6的形成,进而也可以作为空穴阻止层兼电子传输层6来使用。
[0269]
空穴阻止层中使用的化合物也可以分别单独成膜,但也可以混合2种以上来成膜。另外,也可以使用上述化合物中的1种或多种而形成多层、将层叠这样的层而成的多层膜设为空穴阻止层。
[0270]
在具有使用上述高分子量化合物而形成的有机层的有机el元件中,电子传输层6可以使用其本身公知的电子传输性化合物、例如以alq3、balq为代表的喹啉酚衍生物的金属络合物以及各种金属络合物、吡啶衍生物、嘧啶衍生物、三唑衍生物、三嗪衍生物、噁二唑衍生物、噻二唑衍生物、碳二酰亚胺衍生物、喹喔啉衍生物、菲咯啉衍生物、硅杂环戊二烯衍生物、苯并咪唑衍生物等来形成。
[0271]
电子传输层6中使用的化合物也可分别单独成膜,但也可以混合2种以上来成膜。另外,也可以使用上述化合物中的1种或多种而形成多层、将层叠这样的层而成的多层膜设为空穴阻止层。
[0272]
进而,在具备使用上述高分子量化合物而形成的有机层的有机el元件中,根据需要所设置的电子注入层(未图示)也可以使用其本身公知的化合物、例如氟化锂、氟化铯等碱金属盐、氟化镁等碱土金属盐、氧化铝等金属氧化物、锂喹啉等有机金属络合物等来形成。
[0273]
作为具备使用上述高分子量化合物而形成的有机层的有机el元件的阴极7,可以使用如铝之类的功函数低的电极材料以及如镁银合金、镁铟合金及铝镁合金之类的功函数更低的合金作为电极材料。
[0274]
如上所述,通过使用本发明的高分子量化合物来形成空穴注入层、空穴传输层、发光层及电子阻挡层中的至少任一层,可以得到发光效率及电力效率高、实用驱动电压低、发光开始电压也低、具有极优异的耐久性的有机el元件。特别是,在该有机el元件中,具有高发光效率,并且驱动电压降低,电流耐性得到改善,最大发光亮度提高。
[0275]
实施例
[0276]
以下,通过以下的实验例来说明本发明,但本发明并不限于以下实施例。
[0277]
需要说明的是,在以下的说明中,将本发明的高分子量化合物所具有的由通式(1)表示的结构单元表示为“结构单元a”,将由通式(4)表示的连结结构单元表示为“结构单元b”,将热交联性结构单元表示为“结构单元c”,将由不是通式(1)的三芳基胺构成的结构单元表示为“结构单元d”。
[0278]
所合成的化合物的纯化通过利用柱层析的纯化、利用溶剂的晶析法来进行。化合物的鉴定通过nmr分析来进行。
[0279]
为了制造高分子量化合物,合成了以下的中间体1~14。
[0280]
<中间体1的合成>
[0281]
[化学式14]
[0282][0283]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0284]
2-溴苯甲酸甲酯:25.0g
[0285]
二苯并呋喃-4-硼酸:27.1g
[0286]
碳酸钾:32.1g
[0287]
甲苯:200ml
[0288]
乙醇:100ml
[0289]
水:75ml
[0290]
接着,加入四三苯基膦钯(0)1.3g进行加热,在78℃下搅拌6小时。冷却至室温后,加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,使用硅胶175g进行吸附纯化,在减压下进行浓缩,由此得到中间体1的淡黄色油32.8g(收率93.2%)。
[0291]
<中间体2的合成>
[0292]
[化学式15]
[0293][0294]
将下述的成分加入经过氮气置换的反应容器中,冷却至0℃。
[0295]
中间体1:25.4g
[0296]
thf:245ml
[0297]
接着,缓缓地滴加2m正辛基溴化镁的二乙基醚溶液100ml后,升温至室温。合计搅拌27小时后,加入10wt%氯化铵水溶液和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(正己烷/氯仿)进行纯化,由此得到中间体2的白色固体11.4g(收率28.3%)。
[0298]
<中间体3的合成>
[0299]
[化学式16]
[0300][0301]
将下述的成分加入经过氮气置换的反应容器中,冷却至-65℃。
[0302]
中间体2:12.8g
[0303]
二氯甲烷:130ml
[0304]
接着,加入三氟化硼二乙基醚络合物4.0g,缓缓地升温至室温,合计搅拌8小时。缓缓地加入饱和碳酸氢钠水溶液,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(正己烷)进行纯化,由此得到中间体3的无色油11.9g(收率96.4%)。
[0305]
<中间体4的合成>
[0306]
[化学式17]
[0307][0308]
将下述的成分加入经过氮气置换的反应容器中,冷却至0℃。
[0309]
中间体3:11.8g
[0310]
二氯甲烷:120ml
[0311]
接着,加入溴1.3ml,搅拌7小时。加入10wt%硫代硫酸钠水溶液,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到中间体4的白色固体13.1g(收率95.3%)。
[0312]
<中间体5的合成>
[0313]
[化学式18]
[0314][0315]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0316]
中间体4:12.9g
[0317]
三苯基胺-4-硼酸频哪醇酯:9.4g
[0318]
2m-碳酸钾水溶液:18ml
[0319]
甲苯:57ml
[0320]
乙醇:14ml
[0321]
接着,加入四三苯基膦钯(0)0.27g,进行加热,在回流下搅拌16小时。冷却至室温后,加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(正己烷/甲苯)进行纯化,由此得到中间体5的无色油17.8g(收率106%)。
[0322]
<中间体6的合成>
[0323]
[化学式19]
[0324][0325]
将下述的成分加入经过氮气置换的反应容器中。
[0326]
中间体5:16.0g
[0327]
thf:160ml
[0328]
接着,加入n-溴琥珀酰亚胺7.9mg,搅拌10小时。加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到中间体6的无色油20.9g(收率107%)。
[0329]
<中间体7的合成>
[0330]
[化学式20]
[0331][0332]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0333]
中间体6:19.4g
[0334]
双(频哪醇合)二硼:12.3g
[0335]
乙酸钾:6.5g
[0336]
1,4-二噁烷:200ml
[0337]
接着,加入[1,1
’‑
双(二苯基膦基)二茂铁]二氯化钯(ii)的二氯甲烷加成物
0.36g,进行加热,在100℃下搅拌6小时。冷却至室温后,加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(甲苯)进行纯化,由此得到中间体7的白色粉体10.7g(收率49.1%)。
[0338]
<中间体8的合成>
[0339]
[化学式21]
[0340][0341]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0342]
n,n-双(4-溴苯基)-n-(苯并环丁烯-4-基)-胺:8.0g
[0343]
双(频哪醇合)二硼:9.9g
[0344]
乙酸钾:4.6g
[0345]
1,4-二噁烷:80ml
[0346]
接着,加入[1,1
’‑
双(二苯基膦基)二茂铁]二氯化钯(ii)的二氯甲烷加成物0.3g,进行加热,在90℃下搅拌11小时。冷却至室温后,加入自来水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸镁脱水后,在减压下进行浓缩,由此得到粗制物。利用甲苯/甲醇=1/2使粗制物重结晶,由此得到中间体8的白色粉体3.4g(收率35%)。
[0347]
<中间体9的合成>
[0348]
[化学式22]
[0349][0350]
将下述的成分加入经过氮气置换的反应容器中,进行冰冷却。
[0351]
氯化铈(iii):118.9g
[0352]
thf:500ml
[0353]
接着,缓缓地滴加1m正己基镁溴化物的thf溶液482ml后,搅拌1小时,缓缓地滴加溶解于thf 200ml的中间体1,升温至室温。在室温下搅拌2小时后,加入10wt%氯化铵水溶液和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物进行甲醇清洗,由此得到中间体9的白色固体54.5g(收率76.6%)。
[0354]
<中间体10的合成>
[0355]
[化学式23]
[0356][0357]
将下述的成分加入经过氮气置换的反应容器中,冷却至-65℃。
[0358]
中间体9:63.6g
[0359]
二氯甲烷:640ml
[0360]
接着,加入三氟化硼二乙基醚络合物22.6g,缓缓地升温至室温,合计搅拌13小时。缓缓地加入饱和碳酸氢钠水溶液,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用乙腈进行清洗,由此得到中间体10的白色固体56.6g(收率92.8%)。
[0361]
<中间体11的合成>
[0362]
[化学式24]
[0363][0364]
将下述的成分加入经过氮气置换的反应容器中,冷却至0℃。
[0365]
中间体10:56.6g
[0366]
二氯甲烷:560ml
[0367]
接着,加入溴7.2ml,搅拌3小时。加入10wt%硫代硫酸钠水溶液,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到中间体11的淡黄色油72.4g(收率108.3%)。
[0368]
<中间体12的合成>
[0369]
[化学式25]
[0370][0371]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0372]
中间体11:26.0g
[0373]
三苯基胺-4-硼酸频哪醇:22.1g
[0374]
2m碳酸钾水溶液:40ml
[0375]
甲苯:115ml
[0376]
乙醇:28ml
[0377]
接着,加入四三苯基膦钯(0)0.60g,进行加热,在回流下搅拌23小时。冷却至室温后,加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(正己烷)进行纯化,由此得到中间体12的无色油25.2g(收率73.0%)。
[0378]
<中间体13的合成>
[0379]
[化学式26]
[0380][0381]
将下述的成分加入经过氮气置换的反应容器中。
[0382]
中间体12:32.1g
[0383]
thf:325ml
[0384]
接着,加入n-溴琥珀酰亚胺17.5g,在室温下搅拌12小时。加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到中间体13的淡黄色油41.7g(收率105%)。
[0385]
<中间体14的合成>
[0386]
[化学式27]
[0387][0388]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0389]
中间体13:41.0g
[0390]
双(频哪醇合)二硼:26.9g
[0391]
乙酸钾:14.2g
[0392]
1,4-二噁烷:400ml
[0393]
接着,加入[1,1
’‑
双(二苯基膦基)二茂铁]二氯化钯(ii)的二氯甲烷加成物0.78g,进行加热,在100℃下搅拌10小时。冷却至室温后,加入水和甲苯,进行分液操作,由此收集有机层。将该有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗制物。将粗制物用柱层析(甲苯)进行纯化,由此得到中间体14的白色固体13.8g(收率31.2%)。
[0394]
<实施例1>
[0395]
(高分子量化合物a的合成)
[0396]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0397]
中间体7:5.0g
[0398]
1,3-二溴苯:1.5g
[0399]
中间体8:0.7g
[0400]
磷酸三钾:5.7g
[0401]
甲苯:9ml
[0402]
水:5ml
[0403]
1,4-二噁烷:27ml
[0404]
接着,加入乙酸钯(ii)1.2mg及三邻甲苯基膦9.5mg,进行加热,在82℃下搅拌11小时。之后,加入苯基硼酸15mg,搅拌1.5小时,接着,加入溴苯200mg,搅拌1.5小时。加入甲苯50ml、5wt%n,n-二乙基二硫代氨基甲酸钠水溶液50ml,进行加热,在回流下搅拌2小时。冷却至室温后,进行分液操作,由此收集有机层,用饱和食盐水进行3次清洗。将有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗聚合物。使粗聚合物溶解于甲苯中,加入硅胶,进行吸附纯化,再过滤而除去硅胶。将所得的滤液在减压下浓缩,对干固物加入甲苯100ml而使其溶解,滴加至正己烷300ml中,过滤收集所得的沉淀物。将该操作重复3次,使其干燥,由此得到3.5g(收率77%)的高分子量化合物a。
[0405]
高分子化合物a利用gpc测定得到的平均分子量、分散度如下所示。
[0406]
数均分子量mn(聚苯乙烯换算):30,000
[0407]
重均分子量mw(聚苯乙烯换算):52,000
[0408]
分散度(mw/mn):1.7
[0409]
另外,对高分子化合物a进行nmr测定。将1h-nmr测定结果示于图3中。化学组成式如下所示。
[0410]
[化学式28]
[0411][0412]
高分子量化合物a
[0413]
正如由上述化学组成所理解那样,该高分子化合物a包含40mol%的由通式(1)表示的结构单元a、包含50mol%的由通式(4)表示的结构单元b、并且以10mol%的量含有热交联性结构单元c。
[0414]
<实施例2>
[0415]
(高分子量化合物b的合成)
[0416]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0417]
中间体14:6.4g
[0418]
1,3-二溴苯:1.8g
[0419]
中间体8:0.4g
[0420]
磷酸三钾:6.9g
[0421]
甲苯:9ml
[0422]
水:5ml
[0423]
1,4-二噁烷:27ml
[0424]
接着,加入乙酸钯(ii)1.5mg及三邻甲苯基膦11.4mg,进行加热,在82℃下搅拌19小时。之后,加入苯基硼酸18mg,搅拌2小时,接着,加入溴苯243mg,搅拌2小时。加入甲苯50ml、5wt%n,n-二乙基二硫代氨基甲酸钠水溶液50ml,进行加热,在回流下搅拌2小时。冷却至室温后,进行分液操作,由此收集有机层,用饱和食盐水进行3次清洗。将有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗聚合物。使粗聚合物溶解于甲苯中,加入硅胶,进行吸附纯化,再过滤而除去硅胶。将所得的滤液在减压下浓缩,对干固物加入甲苯100ml而使其溶解,滴加至正己烷300ml中,过滤收集所得的沉淀物。将该操作重复3次,使其干燥,由此得到5.0g(收率91%)的高分子量化合物b。
[0425]
高分子化合物b利用gpc测定得到的平均分子量、分散度如下所示。
[0426]
数均分子量mn(聚苯乙烯换算):22,000
[0427]
重均分子量mw(聚苯乙烯换算):37,000
[0428]
分散度(mw/mn):1.7
[0429]
另外,对高分子化合物b进行nmr测定。将1h-nmr测定结果示于图4中。化学组成式如下所示。
[0430]
[化学式29]
[0431][0432]
高分子量化合物b
[0433]
正如由上述化学组成所理解那样,该高分子化合物b包含45mol%的由通式(1)表示的结构单元a、包含50mol%的由通式(4)表示的结构单元b、并且以5mol%的量含有热交联性结构单元c。
[0434]
<实施例3>
[0435]
(高分子量化合物c的合成)
[0436]
将下述的成分加入经过氮气置换的反应容器中,通入30分钟氮气。
[0437]
中间体14:4.1g
[0438]
[对(2-萘基)苯基]双[对(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)苯基]胺:1.4g
[0439]
1,3-二溴苯:1.7g
[0440]
中间体8:0.4g
[0441]
磷酸三钾:6.5g
[0442]
甲苯:9ml
[0443]
水:5ml
[0444]
1,4-二噁烷:27ml
[0445]
接着,加入乙酸钯(ii)1.4mg及三邻甲苯基膦10.6mg,进行加热,在82℃下搅拌21小时。之后,加入苯基硼酸17mg,搅拌2小时,接着,加入溴苯243mg,搅拌2小时。加入甲苯50ml、5wt%n,n-二乙基二硫代氨基甲酸钠水溶液50ml,进行加热,在回流下搅拌2小时。冷却至室温后,进行分液操作,由此收集有机层,用饱和食盐水进行3次清洗。将有机层用无水硫酸钠脱水后,在减压下进行浓缩,由此得到粗聚合物。使粗聚合物溶解于甲苯中,加入硅胶,进行吸附纯化,并过滤而除去硅胶。将所得的滤液在减压下浓缩,对干固物加入甲苯100ml而使其溶解,滴加至正己烷300ml中,过滤收集所得的沉淀物。将该操作重复3次,使其干燥,由此得到3.8g(收率84%)的高分子量化合物c。
[0446]
高分子化合物c利用gpc测定得到的平均分子量、分散度如下所示。
[0447]
数均分子量mn(聚苯乙烯换算):17,000
[0448]
重均分子量mw(聚苯乙烯换算):35,000
[0449]
分散度(mw/mn):2.1
[0450]
另外,对高分子化合物c进行nmr测定。将1h-nmr测定结果示于图5中。化学组成式
如下所示。
[0451]
[化学式30]
[0452][0453]
高分子量化合物c
[0454]
正如由上述化学组成所理解那样,该高分子化合物c包含30mol%的由通式(1)表示的结构单元a、包含50mol%的由通式(4)表示的结构单元b、包含5mol%的热交联性结构单元c、并且以15mol%的量含有由非通式(1)的三芳基胺构成的结构单元d。
[0455]
<实施例4>
[0456]
(功函数的测定)
[0457]
使用实施例1~3中合成的高分子量化合物a~c,在ito基板上制作膜厚100nm的涂布膜,用电离势测定装置(住友重机械工业株式会社制、pys-202型)测定功函数。将结果示于表1中。
[0458]
[表1]
[0459] 功函数(ev)高分子量化合物a5.77高分子量化合物b5.77高分子量化合物c5.75
[0460]
可知:本发明的高分子量化合物a~c与npd、tpd等一般的空穴传输材料所具有的功函数5.4ev相比,显示更适合的能级,具有良好的空穴传输能力。
[0461]
《实施例5》
[0462]
(有机el元件的制作和评价)
[0463]
制作图1所示的层结构的有机el元件,进行特性评价。
[0464]
具体而言,将成膜有膜厚50nm的ito的玻璃基板1用有机溶剂清洗后,用uv/臭氧处理清洗ito表面。以覆盖设置于该玻璃基板1的透明阳极2(ito)的方式,利用旋涂法以50nm的厚度成膜pedot/pss(heraeus制),在热板上,以200℃干燥10分钟,形成空穴注入层3。
[0465]
将实施例1中得到的高分子量化合物a以0.6wt%溶解于甲苯中,制备成涂布液。将如上述那样形成有空穴注入层3的基板移入用干燥氮进行过置换的手套箱内,在热板上以230℃干燥10分钟后,在空穴注入层3上,使用上述的涂布液通过旋涂而形成25nm厚度的涂布层,进而,在热板上以220℃干燥30分钟,形成空穴传输层4。
[0466]
将如上述那样形成有空穴传输层4的基板安装于真空蒸镀机内,减压至0.001pa以
下。在空穴传输层4上,通过下述结构式的蓝色发光材料(emd-1)和主体材料(emh-1)的二元蒸镀,形成膜厚34nm的发光层5。需要说明的是,在二元蒸镀中,将蒸镀速度比设为emd-1:emh-1=4:96。
[0467]
[化学式31]
[0468][0469]
作为电子传输材料,准备了下述结构式的化合物、etm-1及etm-2。
[0470]
[化学式32]
[0471][0472]
在上述形成的发光层5上,使用上述的电子传输材料etm-1及etm-2,通过二元蒸镀形成膜厚20nm的电子传输层6。
[0473]
需要说明的是,在二元蒸镀中,将蒸镀速度比设为etm-1:etm-2=50:50。
[0474]
最后,以成为膜厚100nm的方式蒸镀铝,形成阴极7。
[0475]
这样,将形成有透明阳极2、空穴注入层3、空穴传输层4、发光层5、电子传输层6及阴极7的玻璃基板移动至用干燥氮气进行过置换的手套箱内,使用uv固化树脂,贴合密封用的其它玻璃基板,制成有机el元件。
[0476]
对所制作的有机el元件,在大气中且常温下进行了特性测定。
[0477]
另外,测定了对所制作的有机el元件施加直流电压时的发光特性。
[0478]
上述的测定结果如表2所示。
[0479]
<实施例6>
[0480]
代替高分子量化合物a而使实施例2中得到的高分子量化合物b以0.6wt%溶解于甲苯,调制成涂布液,使用该涂布液形成空穴传输层4,除此以外,与实施例5完全相同地制作有机el元件。对所制作的有机el元件,与实施例5相同地评价各种特性,将其结果示于表2中。
[0481]
<实施例7>
[0482]
代替高分子量化合物a而使实施例3中得到的高分子量化合物c以0.6wt%溶解于甲苯中,调制成涂布液,使用该涂布液形成空穴传输层4,除此以外,与实施例5完全相同地制作有机el元件。对所制作的有机el元件,与实施例5相同地评价各种特性,将其结果示于表2中。
[0483]
<比较例1>
[0484]
代替高分子量化合物a而使下述的tfb(空穴传输性聚合物)以0.6wt%溶解于甲苯,调制成涂布液,使用该涂布液形成空穴传输层4,除此以外,与实施例5完全相同地制作有机el元件。
[0485]
[化学式33]
[0486][0487]
tfb(空穴传输性聚合物)为聚[(9,9-二辛基芴基-2,7-二基)-共-(4,4
’‑
(n-(4-仲丁基苯基))二苯基胺](american dye source公司制、hole transport polymer ads259be)。对该比较例1的有机el元件,与实施例5相同地评价各种特性,将其结果示于表2中。
[0488]
需要说明的是,在各种特性的评价中,电压、亮度、发光效率及电力效率为流入电流密度10ma/cm2的电流时的值。另外,元件寿命是将发光开始时的发光亮度(初始亮度)设为700cd/m2进行恒定电流驱动时以发光亮度衰减至560cd/m2(相当于将初始亮度设为100%时的80%:80%衰减)的时间的形式进行测定。
[0489]
[表2]
[0490][0491]
如表2所示,关于流入电流密度10ma/cm2的电流时的发光效率,比较例1的有机el元件为5.52cd/a,相对于此,实施例5的有机el元件为9.74cd/a,实施例6的有机el元件为9.57cd/a,实施例7的有机el元件为9.37cd/a,均为高效率。另外,关于元件寿命(80%衰减),比较例1的有机el元件为6小时,相对于此,实施例5的有机el元件为13小时,实施例6的有机el元件为35小时,实施例7的有机el元件为38小时,均为长寿命。
[0492]
<实施例8>
[0493]
制作图2所示的层结构的有机el元件,进行特性评价。
[0494]
具体而言,将成膜有膜厚50nm的ito的玻璃基板8用有机溶剂清洗后,用uv/臭氧处理清洗ito表面。以覆盖设置于该玻璃基板8的透明阳极9(ito)的方式,利用旋涂法以50nm的厚度成膜pedot/pss(heraeus制),在热板上,以200℃干燥10分钟,形成空穴注入层10。
[0495]
将下述结构式的高分子量化合物htm-1以0.4wt%溶解于甲苯中,制备成涂布液。将如上述那样形成有空穴注入层10的基板移入用干燥氮进行过置换的手套箱内,在热板上以230℃干燥10分钟后,在空穴注入层10上,使用上述的涂布液通过旋涂而形成15nm厚度的涂布层,进而,在热板上以220℃干燥30分钟,形成空穴传输层11。
[0496]
[化学式34]
[0497][0498]
将实施例1中得到的高分子量化合物a以0.4wt%溶解于甲苯中,制备成涂布液。在空穴传输层11上,使用上述的涂布液通过旋涂而形成15nm厚度的涂布层,进而,在热板上以220℃干燥30分钟,形成电子阻挡层12。
[0499]
将如上述那样形成有电子阻挡层12的基板安装于真空蒸镀机内,减压至0.001pa以下。在电子阻挡层12上,通过蓝色发光材料(emd-1)和主体材料(emh-1)的二元蒸镀,形成膜厚34nm的发光层13。需要说明的是,在二元蒸镀中,将蒸镀速度比设为emd-1:emh-1=4:96。
[0500]
在上述形成的发光层13上,使用电子传输材料etm-1及etm-2,通过二元蒸镀形成膜厚20nm的电子传输层14。需要说明的是,在二元蒸镀中,将蒸镀速度比设为etm-1:etm-2=50:50。
[0501]
最后,以成为膜厚100nm的方式蒸镀铝,形成阴极15。
[0502]
这样,将形成有透明阳极9、空穴注入层10、空穴传输层11、电子阻挡层12、发光层13、电子传输层14及阴极15的玻璃基板移动至用干燥氮气进行过置换的手套箱内,使用uv固化树脂,贴合密封用的其它玻璃基板,制成有机el元件。对所制作的有机el元件,在大气中且常温下进行特性测定。另外,测定对所制作的有机el元件施加直流电压时的发光特性。上述的测定结果如表3所示。
[0503]
<实施例9>
[0504]
代替高分子量化合物a而将实施例2中得到的高分子量化合物b以0.4wt%溶解于甲苯中,调制成涂布液,使用该涂布液形成电子阻挡层12,除此以外,与实施例8完全相同地
制作有机el元件。对所制作的有机el元件,在大气中且常温下进行特性测定。将对所制作的有机el元件施加直流电压时的发光特性的测定结果归纳示于表3中。
[0505]
<实施例10>
[0506]
代替高分子量化合物a而将实施例3中得到的高分子量化合物c以0.4wt%溶解于甲苯中,调制成涂布液,使用该涂布液形成电子阻挡层12,除此以外,与实施例8完全相同地制作有机el元件。对所制作的有机el元件,在大气中且常温下进行特性测定。将对所制作的有机el元件施加直流电压时的发光特性的测定结果归纳示于表3中。
[0507]
<比较例2>
[0508]
制作图1所示的层结构的有机el元件,进行特性评价。
[0509]
具体而言,将成膜有膜厚50nm的ito的玻璃基板1用有机溶剂清洗后,用uv/臭氧处理清洗ito表面。以覆盖设置于该玻璃基板1的透明阳极2(ito)的方式,利用旋涂法以50nm的厚度成膜pedot/pss(heraeus制),在热板上以200℃干燥10分钟,形成空穴注入层3。
[0510]
将高分子量化合物htm-1以0.6wt%溶解于甲苯中,制备成涂布液。将如上述那样形成有空穴注入层3的基板移入用干燥氮进行过置换的手套箱内,在空穴注入层3上,使用上述的涂布液通过旋涂而形成25nm厚度的涂布层,进而,在热板上以220℃干燥30分钟,形成空穴传输层4。
[0511]
将如上述那样形成有空穴传输层4的基板安装于真空蒸镀机内,减压至0.001pa以下。在空穴传输层4上,通过蓝色发光材料(emd-1)和主体材料(emh-1)的二元蒸镀,形成膜厚34nm的发光层5。需要说明的是,在二元蒸镀中,将蒸镀速度比设为emd-1:emh-1=4:96。
[0512]
在上述形成的发光层5上,通过使用电子传输材料(etm-1)及(etm-2)的二元蒸镀,形成膜厚20nm的电子传输层6。需要说明的是,在二元蒸镀中,将蒸镀速度比设为etm-1:etm-2=50:50。
[0513]
最后,以成为膜厚100nm的方式蒸镀铝,形成阴极7。
[0514]
将这样形成有透明阳极2、空穴注入层3、空穴传输层4、发光层5、电子传输层6及阴极7的玻璃基板移动至用干燥氮进行过置换的手套箱内,使用uv固化树脂,贴合密封用的其它玻璃基板,制成有机el元件。对所制作的有机el元件,在大气中且常温下进行特性测定。另外,测定对所制作的有机el元件施加直流电压时的发光特性。上述的测定结果如表3所示。
[0515]
需要说明的是,在各种特性的评价中,电压、亮度、发光效率及电力效率为流入电流密度10ma/cm2的电流时的值。另外,元件寿命是以将发光开始时的发光亮度(初始亮度)设为700cd/m2进行恒定电流驱动时以发光亮度衰减值560cd/m2(相当于将初始亮度设为100%时的80%:80%衰减)的时间的形式进行测定。
[0516]
[表3]
[0517][0518]
如表3所示,关于流入电流密度10ma/cm2的电流时的发光效率,比较例2的有机el元件为7.56cd/a,相对于此,实施例8的有机el元件为9.30cd/a,实施例9的有机el元件为8.88cd/a,实施例10的有机el元件为8.55cd/a,均为高效率。另外,关于元件寿命(80%衰减),比较例2的有机el元件为20小时,相对于此,实施例8的有机el元件为41小时,实施例9的有机el元件为73小时,实施例10的有机el元件为63小时,均为长寿命。
[0519]
由此可知:具备使用本发明的高分子量化合物而形成的有机层的有机el元件与以往的有机el元件相比,能够实现高发光效率、长寿命的有机el元件。
[0520]
本发明的高分子量化合物由于空穴传输能力高、电子阻挡能力优异、热交联性良好,因此作为涂布型有机el元件用的化合物而较为优异。通过使用该化合物而制作涂布型有机el元件,从而能够得到高发光效率及高电力效率,并且能够改善耐久性。由此,能够向例如家电化制品、照明等宽泛用途中展开。
[0521]
(附图标记说明)
[0522]
1、8:玻璃基板
[0523]
2、9:透明阳极
[0524]
3、10:空穴注入层
[0525]
4、11:空穴传输层
[0526]
5、13:发光层
[0527]
6、14:电子传输层
[0528]
7、15:阴极
[0529]
12:电子阻挡层
当前第1页1
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!