变异解释获取方法及装置与流程-j9九游会真人
1.本发明实施例涉及医学信息技术领域,尤其涉及一种变异解释获取方法及 装置。
背景技术:
2.高通量测序是对遗传性疾病进行分子诊断的有力手段,通过其二级分析产 生的大量变异(以全外显子测序为例,数量约为3至4万),需在三级分析中 进行注释与解读,从中甄别出部分变异纳入检测报告。该过程的甄别标准,即 该变异是否能够“解释(explain)”受检案例的病因。
3.通常会从三个维度考虑变异对受检案例的解释程度:一、该变异在生物学 功能上是否有害(有损正常功能、能够致病);二、该变异所在基因的相关表 型(已被证明的该基因异常能够导致的表型或疾病)与受检案例的临床表现在 多大程度上相似;另外,还会考虑该变异在个体中的合性(zygosity)与该个体 的受累状况与该变异所在基因的相关疾病的遗传模式是否相符。
4.但是,上述各个解释维度使得甄别病因变异的过程依赖于分析人员的反复 权衡,效率很低,也使得变异排序结果不准确。
5.因此,如何提高变异排序结果精确性和病因变异分析的效率,就成为亟需 解决的技术问题。
技术实现要素:
6.本发明实施例解决的技术问题是如何提高变异排序结果精确性和病因变异 分析的效率。
7.为解决上述问题,本发明实施例提供一种变异解释获取方法,适于获取检 出遗传变异对受检案例的变异解释,包括:
8.获取所述受检案例的检出遗传变异;
9.基于所述检出遗传变异,获取所述检出遗传变异对应的变异组合,所述变 异组合包括所述检出遗传变异、所述检出遗传变异对应的基因、所述基因对应 的疾病及所述疾病对应的遗传模式;
10.根据所述变异组合中的所述检出遗传变异、所述检出遗传变异对应的基因、 所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出遗传变异的变异 致病性、与所述疾病对应的疾病相似性和与所述遗传模式对应的孟德尔遗传一 致性三者中的至少两者;
11.根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者中所 获取的至少两者获取所述变异组合的所述变异解释。
12.可选地,所述基于所述检出遗传变异,获取所述检出遗传变异对应的变异 组合的步骤包括:
13.基于所述检出遗传变异,获取所述检出遗传变异对应的各个基因;
14.获取各个所述基因对应的疾病;
15.根据各个所述疾病,得到对应的遗传模式;
16.将相互对应的所述检出遗传变异、所述基因、所述疾病和所述遗传模式进 行组合,得到各个所述变异组合。
17.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出 遗传变异的变异致病性、与所述疾病对应的疾病相似性和与所述遗传模式对应 的孟德尔遗传一致性三者中的至少两者的步骤包括:
18.确定各个变异组合中的当前变异组合;
19.执行以下步骤中的至少两者,获取所述变异致病性、所述疾病相似性和所 述孟德尔遗传一致性三者中的至少两者:
20.根据所述当前变异组合中的所述检出遗传变异、所述基因、所述疾病和所 述遗传模式获得当前变异致病性;
21.根据所述当前变异组合中的所述疾病获得当前疾病相似性;
22.至少根据所述当前变异组合中的所述检出遗传变异和所述遗传模式获得当 前孟德尔遗传一致性;
23.所述根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者 中所获取的至少两者获取所述变异组合的所述变异解释的步骤包括:
24.根据所述当前变异致病性、所述当前疾病相似性和所述当前孟德尔遗传一 致性三者中所获取的至少两者获取所述当前变异组合的当前变异解释,直至得 到各个所述变异组合对应的各个所述变异解释。
25.可选地,根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性 三者中所获取的至少两者获取所述变异组合的所述变异解释的步骤之后还包括:
26.确定各个所述变异解释的最大值,得到所述检出遗传变异对应的变异解释。
27.可选地,所述根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一 致性三者中所获取的至少两者获取所述变异组合的所述变异解释的步骤包括:
28.通过对所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者中 所获取的至少两者进行叉乘得到变异解释。
29.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出 遗传变异的变异致病性的步骤包括:
30.根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
31.确定各个所述变异证据对应的变异强度,并确定各个所述变异强度对应的 所述变异证据的数量,得到变异证据数量;
32.根据所述变异证据数量获得所述变异致病性。
33.可选地,所述根据所述变异证据数量获得所述变异致病性的步骤包括:
34.根据所述证据数量确定致病强度;
35.获取致病性对应表,所述致病性对应表包括各个致病强度对应的变异致病 性;
36.根据所述致病性对应表确定所述致病强度对应的所述变异致病性。
37.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出 遗传变异的变异致病性的步骤包括:
38.根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
39.确定各个所述变异证据对应的变异强度,并确定各个所述变异强度对应的 所述变异证据的数量,得到变异证据数量;
40.根据所述变异证据数量利用致病机会函数得到联合致病机会;
41.利用所述联合致病机会、致病先验概率获得所述变异致病性,其中,所述 致病先验概率根据所述变异强度确定。
42.可选地,所述变异强度包括非常强变异强度,所述致病先验概率根据所述 变异强度确定的步骤包括:
43.确定所述变异强度为非常强变异强度;
44.根据所述非常强变异强度确定所述致病先验概率。
45.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取与所述疾 病对应的疾病相似性的步骤包括:
46.根据所述受检案例在所述疾病下表现的各个表征获取各个受检案例表征组;
47.根据人类表型本体数据库获取任一疾病表征组,所述任一疾病表征组包括 人类疾病中任一疾病表现的所有的标准疾病表征;
48.根据所述受检案例表征组和所述任一疾病表征组分别获取对应的受检案例 表征关联集和标准疾病表征关联集,所述受检案例表征关联集包括所述受检案 例表征和与所述受检案例表征相关联的子受检案例表征,所述标准疾病表征关 联集包括所述标准疾病表征和与所述标准疾病表征相关联的子标准疾病表征;
49.利用不同的排列规则对所述受检案例表征关联集和所述标准疾病表征关联 集进行排列组合,得到各个所述排列规则对应的排列关联对;
50.根据各个所述排列关联对确定对应的排列杰卡德相似系数;
51.确定各个所述排列杰卡德相似系数中的最大相似系数,根据所述最大相似 系数获得所述疾病相似性。
52.可选地,所述根据各个所述排列关联对确定对应的排列杰卡德相似系数的 步骤包括:
53.确定各个所述排列关联对中的当前排列关联对;
54.根据所述当前排列关联对中包括的各个所述受检案例表征关联集和所述标 准疾病表征关联集的组合对,分别计算各个所述组合对的杰卡德相似系数;
55.加和各个所述组合对的杰卡德相似系数,得到所述当前排列关联对的杰卡 德相似系数;
56.将各个所述排列关联对中的其他排列关联对确定为新的当前排列关联对, 直至得到所有的所述排列杰卡德相似系数。
57.可选地,所述最大相似系数的获取步骤包括:
58.确定所述受检案例表征组中包含的表征数量和所述任一疾病表征组中包含 的表征数量的最大值;
59.对所述最大值取倒数得到所述最大值相似系数。
60.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取与所述遗 传模式对应的孟德尔遗传一致性的步骤包括:
61.当确定所述遗传模式为显性遗传模式时,根据所述显性遗传模式对应的孟 德尔遗传合性确定所述检出遗传变异对应的受检案例及其家庭成员的孟德尔遗 传符合值;
62.将各个所述孟德尔遗传符合值结合得到所述孟德尔遗传一致性。
63.可选地,所述根据所述显性遗传模式对应的孟德尔遗传合性确定所述受检 案例及其家庭成员的孟德尔遗传符合值的步骤包括:
64.根据所述检出遗传变异对应的受检案例确定所述受检案例的各个家庭成员 的受累状况;
65.根据各个所述受累状况和所述疾病对应的所述显性遗传模式确定所述受检 病例和各个所述家庭成员对该所述检出遗传变异的实测基因型;
66.根据所述疾病对应的所述显性遗传模式确定对应的标准基因型;
67.逐个对比各个所述实测基因型和所述标准基因型的受累状况是否相符合, 相符合则将该实测基因型对应的孟德尔遗传符合值计为1,不符合则将所述孟 德尔遗传符合值下降一个数量级;
68.所述将各个所述孟德尔遗传符合值结合得到所述孟德尔遗传一致性的步骤 包括:
69.直至对比完全部的所述实测基因型,将各个所述孟德尔遗传符合值相乘得 到所述孟德尔遗传一致性。
70.可选地,所述根据所述变异组合中的所述检出遗传变异、所述检出遗传变 异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取与所述遗 传模式对应的孟德尔遗传一致性的步骤包括:
71.当确定所述遗传模式为隐性遗传模式时,确定所述隐性遗传模式对应的基 因,根据所述基因确定不同于所述检出遗传变异的各个其他检出遗传变异,将 所述检出遗传变异分别与各个其他检出遗传变异组合得到组合变异对;
72.根据所述隐性遗传模式对应的孟德尔遗传合性确定所述检出遗传变异所对 应的受检案例及其家庭成员的检出遗传变异孟德尔遗传符合值;
73.根据所述隐性遗传模式对应的孟德尔遗传合性确定各个所述组合变异对所 对应的受检案例及其家庭成员的组合变异对孟德尔遗传符合值;
74.将各个所述检出遗传变异孟德尔遗传符合值结合得到检出遗传变异孟德尔 遗传一致性;
75.将各个所述组合变异对孟德尔遗传符合值结合得到各个组合变异对孟德尔 遗传一致性;
76.确定所述检出遗传变异孟德尔遗传一致性和各个所述组合变异对孟德尔遗 传一
致性中的最大值作为所述检出遗传变异对应的孟德尔遗传一致性。
77.本发明实施例提供一种变异解释获取装置,适于获取检出遗传变异对受检 案例的变异解释,包括:
78.检出遗传变异获取模块,适于获取所述受检案例的检出遗传变异;
79.变异组合获取模块,适于基于所述检出遗传变异,获取所述检出遗传变异 对应的变异组合,所述变异组合包括所述检出遗传变异、所述检出遗传变异对 应的基因、所述基因对应的疾病及所述疾病对应的遗传模式;
80.指标获取模块,适于根据所述变异组合中的所述检出遗传变异、所述检出 遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取所 述检出遗传变异的变异致病性、与所述疾病对应的疾病相似性和与所述遗传模 式对应的孟德尔遗传一致性三者中的至少两者;
81.变异解释获取模块,适于根据所述变异致病性、所述疾病相似性和所述孟 德尔遗传一致性三者中所获取的至少两者获取所述变异组合的所述变异解释。
82.可选地,所述变异组合获取模块,适于基于所述检出遗传变异,获取所述 检出遗传变异对应的变异组合,包括:
83.基于所述检出遗传变异,获取所述检出遗传变异对应的各个基因;
84.获取各个所述基因对应的疾病;
85.根据各个所述疾病,得到对应的遗传模式;
86.将相互对应的所述检出遗传变异、所述基因、所述疾病和所述遗传模式进 行组合,得到各个所述变异组合。
87.可选地,所述指标获取模块,适于根据所述变异组合中的所述检出遗传变 异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗 传模式获取所述检出遗传变异的变异致病性、与所述疾病对应的疾病相似性和 与所述遗传模式对应的孟德尔遗传一致性三者中的至少两者,包括:
88.确定各个变异组合中的当前变异组合;
89.执行以下步骤中的至少两者,获取所述变异致病性、所述疾病相似性和所 述孟德尔遗传一致性三者中的至少两者:
90.根据所述当前变异组合中的所述检出遗传变异、所述基因、所述疾病和所 述遗传模式获得当前变异致病性;
91.根据所述当前变异组合中的所述疾病获得当前疾病相似性;
92.至少根据所述当前变异组合中的所述检出遗传变异和所述遗传模式获得当 前孟德尔遗传一致性;
93.所述变异解释获取模块,适于根据所述变异致病性、所述疾病相似性和所 述孟德尔遗传一致性三者中所获取的至少两者获取所述变异组合的所述变异解 释,包括:
94.根据所述当前变异致病性、所述当前疾病相似性和所述当前孟德尔遗传一 致性三者中所获取的至少两者获取所述当前变异组合的当前变异解释,直至得 到各个所述变异组合对应的各个所述变异解释。
95.可选地,所述变异解释获取模块,适于根据所述变异致病性、所述疾病相 似性和所述孟德尔遗传一致性三者中所获取的至少两者获取所述变异组合的所 述变异解释,包
括:
96.确定各个所述变异解释的最大值,得到所述检出遗传变异对应的变异解释。
97.可选地,所述变异解释模块,适于根据所述变异致病性、所述疾病相似性 和所述孟德尔遗传一致性三者中所获取的至少两者获取所述变异组合的所述变 异解释,包括:
98.通过对所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者中 所获取的至少两者进行叉乘得到变异解释。
99.可选地,所述指标获取模块,适于根据所述变异组合中的所述检出遗传变 异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗 传模式获取所述检出遗传变异的变异致病性,包括:
100.根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
101.确定各个所述变异证据对应的变异强度,并确定各个所述变异强度对应的 所述变异证据的数量,得到变异证据数量;
102.根据所述变异证据数量获得所述变异致病性。
103.可选地,所述指标获取模块,适于根据所述变异证据数量获得所述变异致 病性,包括:
104.根据所述证据数量确定致病强度;
105.获取致病性对应表,所述致病性对应表包括各个致病强度对应的变异致病 性;
106.根据所述致病性对应表确定所述致病强度对应的所述变异致病性。
107.可选地,所述指标获取模块,适于根据所述变异组合中的所述检出遗传变 异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗 传模式获取所述检出遗传变异的变异致病性,包括:
108.根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
109.确定各个所述变异证据对应的变异强度,并确定各个所述变异强度对应的 所述变异证据的数量,得到变异证据数量;
110.根据所述变异证据数量利用致病机会函数得到联合致病机会;
111.利用所述联合致病机会、致病先验概率获得所述变异致病性,其中,所述 致病先验概率根据所述变异强度确定。
112.可选地,所述变异强度包括非常强变异强度,所述致病先验概率根据所述 变异强度确定,包括:
113.确定所述变异强度为非常强变异强度;
114.根据所述非常强变异强度确定所述致病先验概率。
115.可选地,所述指标获取模块,适于根据所述变异组合中的所述检出遗传变 异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗 传模式获取与所述疾病对应的疾病相似性,包括:
116.根据所述受检案例在所述疾病下表现的各个表征获取各个受检案例表征组;
117.根据人类表型本体数据库获取任一疾病表征组,所述任一疾病表征组包括 人类疾病中任一疾病表现的所有的标准疾病表征;
118.根据所述受检案例表征组和所述任一疾病表征组分别获取对应的受检案例 表征关联集和标准疾病表征关联集,所述受检案例表征关联集包括所述受检案 例表征和与所述受检案例表征相关联的子受检案例表征,所述标准疾病表征关 联集包括所述标准疾病表征和与所述标准疾病表征相关联的子标准疾病表征;
119.利用不同的排列规则对所述受检案例表征关联集和所述标准疾病表征关联 集进行排列组合,得到各个所述排列规则对应的排列关联对;
120.根据各个所述排列关联对确定对应的排列杰卡德相似系数;
121.确定各个所述排列杰卡德相似系数中的最大相似系数,根据所述最大相似 系数获得所述疾病相似性。
122.可选地,所述指标获取模块,适于根据各个所述排列关联对确定对应的排 列杰卡德相似系数,包括:
123.确定各个所述排列关联对中的当前排列关联对;
124.根据所述当前排列关联对中包括的各个所述受检案例表征关联集和所述标 准疾病表征关联集的组合对,分别计算各个所述组合对的杰卡德相似系数;
125.加和各个所述组合对的杰卡德相似系数,得到所述当前排列关联对的杰卡 德相似系数;
126.将各个所述排列关联对中的其他排列关联对确定为新的当前排列关联对, 直至得到所有的所述排列杰卡德相似系数。
127.可选地,所述指标获取模块,适于确定各个所述排列杰卡德相似系数中的 最大相似系数,包括:
128.确定所述受检案例表征组中包含的表征数量和所述任一疾病表征组中包含 的表征数量的最大值;
129.对所述最大取倒数得到所述最大值相似系数。
130.可选地,所述指标获取模块,适于根据所述变异组合中的所述检出遗传变 异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗 传模式获取与所述遗传模式对应的孟德尔遗传一致性,包括:
131.当确定所述遗传模式为显性遗传模式时,根据所述显性遗传模式对应的孟 德尔遗传合性确定所述检出遗传变异对应的受检案例及其家庭成员的孟德尔遗 传符合值;
132.将各个所述孟德尔遗传符合值结合得到所述孟德尔遗传一致性。
133.可选地,所述指标获取模块,适于根据所述显性遗传模式对应的孟德尔遗 传合性确定所述受检案例及其家庭成员的孟德尔遗传符合值,包括:
134.根据所述检出遗传变异对应的受检案例确定所述受检案例的各个家庭成员 的受累状况;
135.根据各个所述受累状况和所述疾病对应的所述显性遗传模式确定所述受检 病例和各个所述家庭成员对该所述检出遗传变异的实测基因型;
136.根据所述疾病对应的所述显性遗传模式确定对应的标准基因型;
137.逐个对比各个所述实测基因型和所述标准基因型的受累状况是否相符合, 相符合则将该实测基因型对应的孟德尔遗传符合值计为1,不符合则将所述孟 德尔遗传符合值下降一个数量级;
138.所述指标获取模块,适于将各个所述孟德尔遗传符合值结合得到所述孟德 尔遗传一致性,包括:
139.直至对比完全部的所述实测基因型,将各个所述孟德尔遗传符合值相乘得 到所述孟德尔遗传一致性。
140.可选地,所述指标获取模块适于根据所述变异组合中的所述检出遗传变异、 所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模 式获取与所述遗传模式对应的孟德尔遗传一致性,包括:
141.当确定所述遗传模式为隐性遗传模式时,确定所述隐性遗传模式对应的基 因,根据所述基因确定不同于所述检出遗传变异的各个其他检出遗传变异,将 所述检出遗传变异分别与各个其他检出遗传变异组合得到组合变异对;
142.根据所述隐性遗传模式对应的孟德尔遗传合性确定所述检出遗传变异所对 应的受检案例及其家庭成员的检出遗传变异孟德尔遗传符合值;
143.根据所述隐性遗传模式对应的孟德尔遗传合性确定各个所述组合变异对所 对应的受检案例及其家庭成员的组合变异对孟德尔遗传符合值;
144.将各个所述检出遗传变异孟德尔遗传符合值结合得到检出遗传变异孟德尔 遗传一致性;
145.将各个所述组合变异对孟德尔遗传符合值结合得到各个组合变异对孟德尔 遗传一致性;
146.确定所述检出遗传变异孟德尔遗传一致性和各个所述组合变异对孟德尔遗 传一致性中的最大值作为所述检出遗传变异对应的孟德尔遗传一致性。
147.本发明实施例提供一种电子设备,包括至少一个存储器和至少一个处理器; 所述存储器存储有程序,所述处理器调用所述程序,以执行如前述任一项实施 例所述的变异解释获取方法。
148.本发明实施例还提供一种存储介质,所述存储介质存储有适于获取变异解 释的程序,以实现如前述任一项实施例所述的变异解释获取方法。
149.与现有技术相比,本发明实施例的技术方案具有以下优点:
150.本发明实施例所提供的一种变异解释获取方法,适于获取检出遗传变异对 受检案例的变异解释,首先,获取所述受检案例的检出遗传变异;接着,基于 所述检出遗传变异,获取所述检出遗传变异对应的变异组合,所述变异组合包 括所述检出遗传变异、所述检出遗传变异对应的基因、所述基因对应的疾病及 所述疾病对应的遗传模式;然后,根据所述变异组合中的所述检出遗传变异、 所述检出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模 式获取所述检出遗传变异的变异致病性、与所述疾病对应的疾病相似性和与所 述遗传模式对应的孟德尔遗传一致性三者中的至少两者;最后,根据所述变异 致病性、所述疾病相似性和所述孟德尔遗传一致性三者中所获取的至少两者获 取所述变异组合的所述变异解释。
151.可以看出,本技术实施例所提供的变异解释获取方法,基于能够更有力的 解释受检案例的病因情况的检出遗传变异来获取对应的基因、所述基因对应的 疾病以及所述疾病对应的遗传模式,从而得到一个综合性变异组合,然后利用 变异组合将用于定性评价受检案例病因情况的变异致病性、疾病相似性、孟德 尔遗传一致性进行量化,将量化的变异
致病性、疾病相似性、孟德尔遗传一致 性三者中的至少两者结合得到变异解释,这样,一方面,基于检出遗传变异得 到的变异解释可以提高对受检案例病因情况分析的准确度,使得获得的变异解 释更具有可信度,另一方面,将定向分析受检案例的病因情况的指标量化并进 行结合,在对受检案例的病因情况分析时,使得经由量化结合得到的变异解释 对应的检出遗传变异能够在众多病因变异的排列中置于更加显著的位置,从而 可以辅助分析人员进行分析推理,加快得出诊断结论的过程,提高变异排序结 果精确性和病因变异分析的效率。
152.可选方案中,本发明实施例所提供的一种变异解释获取方法,所述基于所 述检出遗传变异,获取所述检出遗传变异对应的变异组合的步骤包括:基于所 述检出遗传变异,获取所述检出遗传变异对应的各个基因;获取各个所述基因 对应的疾病;根据各个所述疾病,得到对应的遗传模式;将相互对应的所述检 出遗传变异、所述基因、所述疾病和所述遗传模式进行组合,得到各个所述变 异组合。这样,可以基于所述检出遗传变异获取与其对应的全部基因、所述基 因对应的全部疾病以及所述疾病对应的遗传模式,从而能够满足在后续获取变 异致病性、疾病相似性和孟德尔遗传一致性的需求,并保证对应于检出遗传变 异的各个变异组合的变异解释的全面性,方便变异解释的最终获取,以及最终 得到的检出遗传变异对应的变异解释的准确性。
附图说明
153.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施 例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述 中的附图仅仅是本技术的实施例,对于本领域普通技术人员来讲,在不付出创 造性劳动的前提下,还可以根据提供的附图获得其他的附图。
154.图1是本技术实施例提供的变异解释获取方法的一流程示意图;
155.图2是本技术实施例提供的变异解释获取方法中根据变异组合获得各个变 异解释指标的一流程示意图;
156.图3是本技术实施例提供的变异解释获取方法中变异致病性获取方法的一 流程示意图;
157.图4为变异证据及其内容的示意图;
158.图5为变异证据数量与致病强度关系表;
159.图6是致病性对应表的示意图;
160.图7为本技术实施例提供的变异解释获取方法中变异致病性获取方法的另 一流程示意图;
161.图8是致病机会函数的使用结果示意图;
162.图9是非常强变异强度与致病先验概率关系示意图;
163.图10是本技术实施例提供的变异解释获取方法中疾病相似性的获取方法 的一流程示意图;
164.图11是本技术实施例提供的变异解释获取方法中孟德尔遗传一致性的获 取方法的一流程示意图;
165.图12是本技术实施例所提供的变异解释获取方法中孟德尔遗传一致性的 获取方
法的另一流程示意图;
166.图13是本技术实施例提供的变异解释获取装置的可选框图;
167.图14是本技术实施例所提供的电子设备的示意图。
具体实施方式
168.由背景技术可知,甄别病因变异的过程依赖于分析人员的反复权衡,效率 很低,也使得变异排序结果不准确。
169.为提高变异排序结果精确性和病因变异分析的效率,本发明实施例提供了 一种变异解释获取方法及装置,其中,变异解释获取方法,适于获取检出遗传 变异对受检案例的变异解释,包括:
170.获取所述受检案例的检出遗传变异;
171.基于所述检出遗传变异,获取所述检出遗传变异对应的变异组合,所述变 异组合包括所述检出遗传变异、所述检出遗传变异对应的基因、所述基因对应 的疾病及所述疾病对应的遗传模式;
172.根据所述变异组合中的所述检出遗传变异、所述检出遗传变异对应的基因、 所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出遗传变异的变异 致病性、与所述疾病对应的疾病相似性和与所述遗传模式对应的孟德尔遗传一 致性三者中的至少两者;
173.根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者中所 获取的至少两者获取所述变异组合的所述变异解释。
174.可以看出,本发明实施例所提供的变异解释获取方法,基于能够更有力的 解释受检案例的病因情况的检出遗传变异来获取对应的基因、所述基因对应的 疾病以及所述疾病对应的遗传模式,从而得到一个综合性变异组合,然后利用 变异组合将用于定性评价受检案例病因情况的变异致病性、疾病相似性、孟德 尔遗传一致性进行量化,将量化的变异致病性、疾病相似性、孟德尔遗传一致 性三者中的至少两者结合得到变异解释,这样,一方面,基于检出遗传变异得 到的变异解释可以提高对受检案例病因情况分析的准确度,使得获得的变异解 释更具有可信度,另一方面,将定向分析受检案例的病因情况的指标量化并进 行结合,在对受检案例的病因情况分析时,使得经由量化结合得到的变异解释 对应的检出遗传变异能够在众多病因变异的排列中置于更加显著的位置,从而 可以辅助分析人员进行分析推理,加快得出诊断结论的过程,提高变异排序结 果精确性和病因变异分析的效率。
175.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清 楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是 全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造 性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
176.需要说明的是,本说明书所涉及到的指示的方位或位置关系为基于附图所 示的方位或位置关系,仅是为了便于描述和简化描述,而不是指示或暗示所指 的装置必须具有特定的方位,以特定的方位构造,因此不能理解为对本发明的 限制。
177.为方便理解本方案,先将本领域的部分基本概念进行说明:
178.高通量测序是指能够一次并行几十万到几百万条dna分子进行序列测定 快速分析核酸序列并产生海量数据的技术,是一种对遗传性疾病进行分子诊断 的有力手段。
179.分子诊断为寻找受检案例的疾病在分子水平(如基因序列)上的原因的一 种诊断方式,受检案例是指当初遗传性疾病进行分子诊断时的接诊单位,通常 由单个人类个体(单先证者案例)或来自同一个家族的具有血缘关系的多个人 类个体(家系案例)构成。
180.基于高通量测序的基因检测流程(即分子诊断)包括一级分析、二级分析 与三级分析这三大步骤。其中,一级分析是指从样本处理、文库构建到上机测 序,最终得到测序片段的过程;二级分析又称“生信分析”,是指将测序片段 比对到参考基因组,获取受检案例的检出遗传变异列表的过程;三级分析又称
ꢀ“
临床注释”,是指对二级分析中获得到的大量检出遗传变异进行功能注释, 并对检出遗传变异进行解读以产生最终用于临川诊断的检测结果与结论、生成 检测报告的过程。
181.其中,检出遗传变异(detected genetic variants)是指通过特定检测方法(如 高通量测序)在某特定样本(如基因组dna样本)中检测到的遗传变异。检 出遗传变异暗示提供该样本的生物学个体(如某患者)携带这些变异。
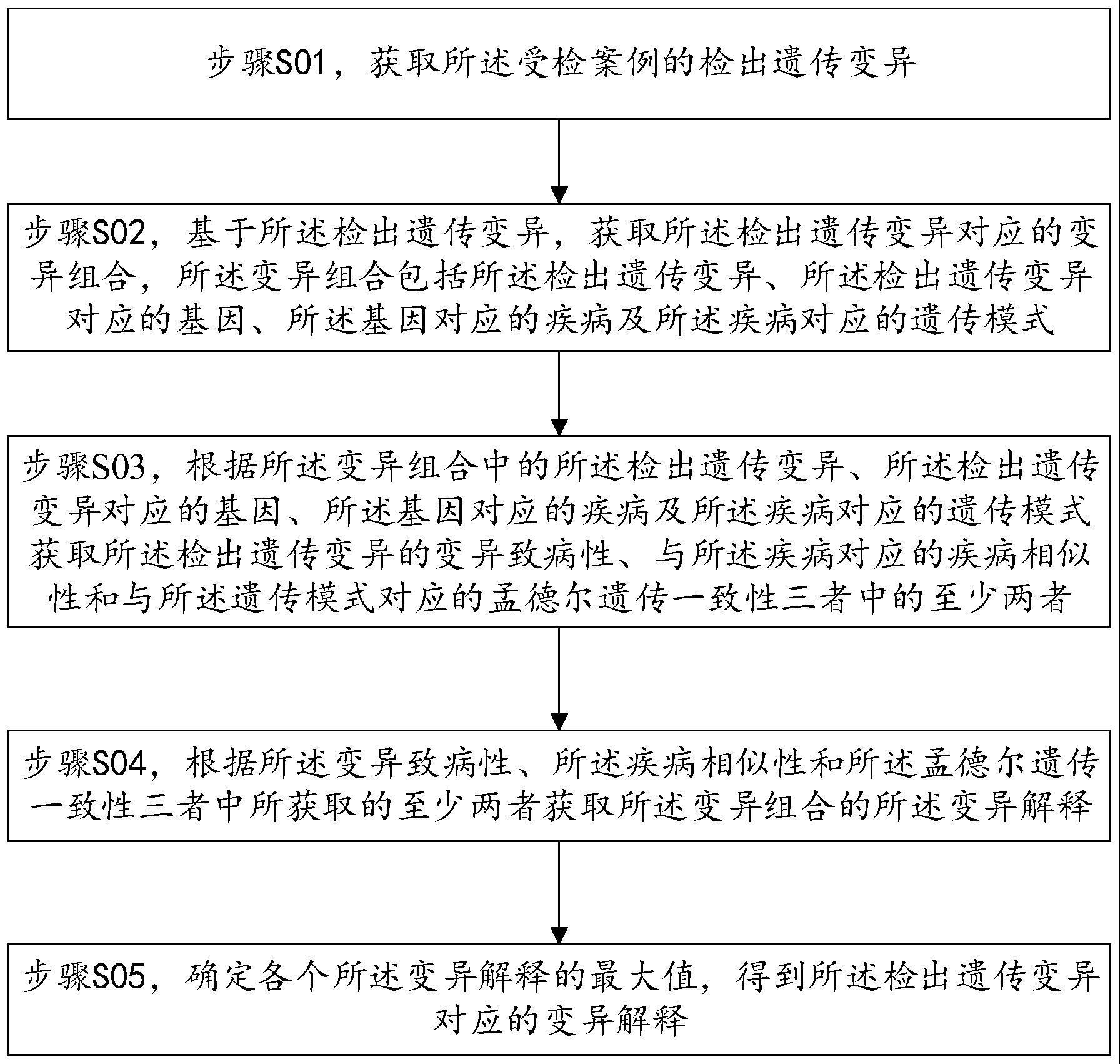
182.测序片段(reads)是高通量测序数据的体现形式,为含有碱基序列和质量 值的序列片段。在二代测序(the next-generation sequencing,ngs)的语境下, 一次检测往往可以产生数百万或数千万条,长度在数十至一两百碱基的测序片 段。
183.在高通量测序的二级分析过程中会产生大量检出遗传变异(例如以全外显 子测序为例,数量约为3至4万),而对于这些大量的检出遗传变异须在三级 分析中进行注释与解读,从大量的检出遗传变异中甄别出部分检出遗传变异(即 导致受检案例致病的最相关的病因变异),然后纳入受检案例病因情况分析的 检测报告。
184.病因变异是指构成受检案例的病因的遗传变异。该病因变异被认为导致了 受检案例接受分子诊断的原因(某遗传性疾病或表型)。
185.三级分析过程的甄别标准,即该检出遗传变异是否能够“解释(explain)
”ꢀ
受检案例。通常会从三个定性指标考虑变异对受检案例的解释程度:(一)该 变异在生物学功能上是否有害(有损正常功能、能够致病);(二)该变异所 在基因的相关表型(已被证明的该基因异常能够导致的表型或疾病)与受检案 例的临床表现在多大程度上相似;(三)还会考虑该检出遗传变异在受检案例 中的合性(zygosity)与该受检案例的受累状况与该检出遗传变异所在基因的相 关疾病的遗传模式是否相符。以上三个维度是考察变异解释的首要指标,其应 用见于临床实践,也被纳入多项指南、规范、共识或标准。为方便说明,在下 文中,上述三个维度分别以“变异致病性”、“疾病相似性”、“孟德尔遗传 一致性”命名。
186.其中,合性是纯合(homozygosity),杂合(heterozygosity)与半合 (hemizygosity)的统称。
187.遗传模式是指遗传性疾病在代际传递时表现出的规律。遗传模式包括常染 色体显性遗传,常染色体隐性遗传,x染色体连锁显性遗传,x染色体连锁隐 性遗传,y染色体连锁遗传等。
188.受累状况表示某个体(受检案例即其父母或其他家人)是否为疾病所累的 状况,可以是“受累(患病/异常)”,也可以是“非受累(健康/正常)”。
189.由于“变异致病性”、“疾病相似性”、“孟德尔遗传一致性”是分别从 不同的角度分
别对受检案例的变异解释进行定性判断的指标,分析人员从这三 个维度分别对受检案例的变异解释进行定性判断时,需要分析人员的反复权衡, 使得甄别病因变异的过程依赖于分析人员,效率很低,且容易受到分析人员的 人为偏好、误差与实务,降低了诊断报告的准确度。
190.因此,为改善上述存在的问题,本技术实施例提供了一种变异解释获取方 法,以提高变异排序结果精确性和病因变异分析的效率。
191.具体的,请参考图1,图1是本技术实施例提供的变异解释获取方法的一 流程示意图。
192.如图1所示,该流程可以包括以下步骤:
193.步骤s01,获取所述受检案例的检出遗传变异。
194.本技术将用于评价所述受检案例的指标均在检出遗传变异的层面上分别进 行获取,因此,首先根据受检案例得到后续操作中需要用的检出遗传变异,即 为前述二级分析得到的可能导致受检案例致病的病因变异。容易理解的是,二 级分析得到的检出遗传变异的数量是非常多的。
195.具体地,获取所述受检案例的检出遗传变异可以为在执行本技术实施例提 供的变异解释获取方法时获取,也可以提前获取并保存,待需要进行变异解释 时,直接从保存的数据中获取检出遗传变异。
196.步骤s02,基于所述检出遗传变异,获取所述检出遗传变异对应的变异组 合,所述变异组合包括所述检出遗传变异、所述检出遗传变异对应的基因、所 述基因对应的疾病及所述疾病对应的遗传模式。
197.在对所述受检案例进行检测分析得到的大量检出遗传变异的基础上,进一 步基于任一所述检出遗传变异,获取检出遗传变异所在基因、基因所对应的疾 病以及其疾病所对应的遗传模式,将所述基因、所述疾病、所述遗传模式进行 组合,得到变异组合。
198.其中,基因可以通过检出遗传变异功能注释的过程得到,基因所对应的疾 病可以通过数据库,如omim或其他信息源得到,疾病所对应的遗传模式可以 通过数据库,如omim,或其他信息来源得到。
199.变异组合中包括的各个元素均为后续得出变异致病性、疾病相似性、孟德 尔遗传一致性所需要的,这样,变异组合的构建可以为后续的步骤提供充分全 面的数据基础。
200.容易理解的是,一个检出遗传变异可能会对应多个变异组合,因此所得到 的变异组合会有多个。
201.具体的,在一种实施方式中,为了方便各个变异组合的获取,并保证所获 取的变异组合的全面性,步骤s02,基于所述检出遗传变异,获取所述检出遗 传变异对应的变异组合可以包括:
202.基于所述检出遗传变异,获取所述检出遗传变异对应的各个基因;
203.获取各个所述基因对应的疾病;
204.根据各个所述疾病,得到对应的遗传模式;
205.将相互对应的所述检出遗传变异、所述基因、所述疾病和所述遗传模式进 行组合,得到各个所述变异组合。
206.需要说明的是,虽然存在部分基因和疾病具有一对一的关系,有些基因和 疾病是
一对多的关系,还有些基因和疾病是多对一的关系的情况,但是本技术 所述变异组合中是围绕一个检出遗传变异获得的基因、疾病和遗传模式之间的 相互关系,因此只要保证一个变异组合中确定的基因、疾病、遗传模式时相对 于同一个检出遗传变异即可。
207.为方便说明,可以将所述检出遗传变异中的任一检出遗传变异定义为 varianti,将所述任一检出遗传变异varianti对应的各个所述基因中的任一基因定 义为gene
i1
,及其任一基因gene
i1
所对应的疾病(即所致的疾病)定义为disease
i1
, 及其疾病disease
i1
所对应的遗传模式定义为moi
i1
,则基于任一检出遗传变异 varianti所对应的任一基因gene
i1
得到的变异组合就可以表示为:
[0208][0209]
可以看出,在检测得到的大量的检出遗传变异中,其中任一检出遗传变异 对应的基因也是有很多的,即一种检出遗传变异可能对应有多个基因,而不同 的基因对应的疾病也是多种的,相应的不同的疾病也会得到不同的遗传模式, 这样,基于检出遗传变异可以得到与所述检出遗传变异关联的任一基因、任一 疾病、任一遗传模式的不同变异组合,保证变异组合的全面性,从而可以根据 不同的检出遗传变异所获得的不同的变异组合得到不同的变异解释,可以丰富 数据所含的信息量,提高后续进行受检案例的病因情况进行分析时的诊断结果 的准确性和可信度。
[0210]
当然,在其他实施例中,也可以通过其他方式获取变异组合,比如仅将重 要的基因、出现较为普遍的疾病进行组合。
[0211]
步骤s03,根据所述变异组合中的所述检出遗传变异、所述检出遗传变异 对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取所述检出遗 传变异的变异致病性、与所述疾病对应的疾病相似性和与所述遗传模式对应的 孟德尔遗传一致性三者中的至少两者。
[0212]
需要说明的是,所述获取所述变异解释的“三者中的至少两者”的组合方 式可以为所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性这三者中 的至少两者的任意组合,可以包括:所述变异致病性、所述疾病相似性以及所 述孟德尔遗传一致性三者组合、所述变异致病性与所述孟德尔遗传一致性两者 组合、所述变异致病性与所述疾病相似性两者组合或者所述孟德尔遗传一致性 与所述疾病相似性两者组合。
[0213]
为了方便理解,本技术在后续介绍中,所例举的“cornelia de langesyndrome 5”与“inflammatory bowel disease 28”的例子使用了上述“所述变异 致病性、所述疾病相似性以及所述孟德尔遗传一致性”这三者均涉及的组合方 式。
[0214]
在其他实施例中,对于某些遗传模式未知或者外显率偏低的遗传疾病,所 述孟德尔遗传一致性无法获取或者可靠性不高,因此可以仅使用将所述变异致 病性和所述疾病相似性二者组合的方式获得所述变异解释。
[0215]
而在另一些实施例中,对于某些遗传异质性太强的疾病(同样的表型可能 由成千上百个基因导致),所述疾病相似性带来的结果的区分度不高,因此可 以仅使用将所述变异致病性与所述孟德尔遗传一致性二者组合的方式获得所述 变异解释。
[0216]
因此,上述所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三 者之间的至少两者是可以自由组合的,只需要保证获得的所述变异解释是准确 可靠的即可。
[0217]
基于前述步骤得到的变异组合,可以分别获得量化的变异致病性、疾病相 似性、
孟德尔遗传一致性,用以后续得到最终的变异解释做基础。
[0218]
根据前述描述可以看出,任一检出遗传变异对应的基因,及其疾病和遗传 模式是多种的,因此得到的变异组合也是多种的,为了根据各个变异组合能够 充分获得变异致病性、疾病相似性以及孟德尔遗传一致性,在一种实施方式中, 可以分别对前述三个指标进行获取,请参考图2,图2是本技术实施例提供的 变异解释获取方法中根据变异组合获得各个变异解释指标的一流程示意图。
[0219]
具体的,如图中所示,该流程可以包括以下步骤:
[0220]
步骤s20,确定各个变异组合中的当前变异组合。
[0221]
由于对应一检出遗传变异的变异组合有很多,为方便获取各个变异解释指 标,首先从各个变异组合中确定出当前进行处理的当前变异组合。
[0222]
步骤s21,执行以下步骤中的至少两者,获取所述变异致病性、所述疾病 相似性和所述孟德尔遗传一致性三者中的至少两者:
[0223]
根据所述当前变异组合中的所述检出遗传变异、所述基因、所述疾病和所 述遗传模式获得当前变异致病性;
[0224]
根据所述当前变异组合中的所述疾病获得当前疾病相似性;
[0225]
至少根据所述当前变异组合中的所述检出遗传变异和所述遗传模式获得当 前孟德尔遗传一致性。
[0226]
由于获得的变异组合的数量很多,为了能够获得每一个变异组合,需要首 先确定第一个需要确定的变异组合,然后将确定好的变异组合定位当前变异组 合,进而对当前变异组合中包含的所述检出遗传变异、所述基因和所述疾病获 得当前变异致病性,根据当前变异组合中的所述疾病获得当前疾病相似性,根 据所述当前变异组合中的所述检出遗传变异和所述遗传模式获得当前孟德尔遗 传一致性具体地,从而基于当前变异组合获取当前用于获取变异解释的各个指 标,确保不会发生缺失和遗漏根据各个变异组合获取变异解释指标的情况。
[0227]
这样,可以根据大量的变异组合中确定的当前变异组合中包括的元素来任 意获得对应的疾病相似性、变异致病性、孟德尔遗传一致性中的两者,根据需 要选择合适的指标获取方法,进而保证所述变异解释的获取。
[0228]
进一步,通过对各个变异组合的获取,从而可以得到与检出遗传变异对应 的各个变异组合的疾病相似性、变异致病性、孟德尔遗传一致性。
[0229]
步骤s04,根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致 性三者中所获取的至少两者获取所述变异组合的所述变异解释。
[0230]
得到各个变异组合的疾病相似性、变异致病性、孟德尔遗传一致性后,进 一步可以获取各个变异组合的变异解释。
[0231]
具体地,可以通过对所述变异致病性、所述疾病相似性和所述孟德尔遗传 一致性三者中所获取的至少两者进行叉乘得到变异解释。
[0232]
通过叉乘的方式,将所述变异致病性、所述疾病相似性和所述孟德尔遗传 一致性三者中所获取的至少两者进行量化,可以将这三个指标中任一两个指标 所包括的情况进行综合从而得到一个新的指标即本技术所述变异解释,使得新 得到的所述变异解释可以包括多种指标所表示的生物学信息,在进行受检案例 的病因情况分析时可信度更高,得到
的分析结果更准确。
[0233]
由于任一检出遗传变异对应的变异组合的数量为多个,因此得到的变异解 释也是多个,为了能够充分获得全部变异组合对应的变异解释,在一种实施方 式中,需要基于各个的变异组合分别获得对应的变异致病性、疾病相似性、孟 德尔遗传一致性,对于当前变异组合,请继续参考图2。
[0234]
如图2所示,该流程还可以包括:
[0235]
步骤s22,根据所述当前变异致病性、所述当前疾病相似性和所述当前孟 德尔遗传一致性三者中所获取的至少两者获取所述当前变异组合的当前变异解 释。
[0236]
步骤s23,确定所述当前变异组合是否为最后一个变异组合,是则执行步 骤s24,否则执行步骤s21。
[0237]
当确定所述当前变异组合为最后一个变异组合时,停止获取变异解释的过 程,即步骤s24。
[0238]
步骤s24,停止获取变异解释。
[0239]
当确定所述当前变异组合不是最后一个变异组合时,则继续执行步骤s21, 直至得到各个所述变异组合对应的各个所述变异解释。
[0240]
这样,可以保证所述检出遗传变异对应的各个变异组合的变异解释,充分 考虑了检出遗传变异所包括的所有基因、疾病、遗传模式,从而使得检出遗传 变异对应的变异解释是不同的量化值,基于检出遗传变异获取不同的变异组合 从而获得不同的变异解释的方法可以充分考虑该检出遗传变异对病因的影响情 况,从而在对受检案例进行病因情况分析时,能够使得分析结果更具有可靠性。
[0241]
将步骤s03中得到的变异致病性、疾病相似性、孟德尔遗传一致性中的任 意两个值进行结合,得到能够用于最终判定检出遗传变异的单一且定量的变异 解释,基于前述步骤可知,检出遗传变异的数量是很大的,因此每一个检出遗 传变异都对应有不同的变异解释,而非通用的同一基因的所有变异具有同样的 取值,这样可以将检出遗传变异的各个变异解释进行区分从而确定对病因情况 分析最有决定性的检出遗传变异。
[0242]
可以看出,本技术实施例所提供的变异解释获取方法,基于能够更有力的 解释受检案例的病因情况的检出遗传变异来获取对应的基因、所述基因对应的 疾病以及所述疾病对应的遗传模式,从而得到一个综合性变异组合,然后利用 变异组合将用于定性评价受检案例病因情况的变异致病性、疾病相似性、孟德 尔遗传一致性进行量化,将量化的变异致病性、疾病相似性、孟德尔遗传一致 性三者中的至少两者结合得到变异解释,这样,一方面,基于检出遗传变异得 到的变异解释可以提高对受检案例病因情况分析的准确度,使得获得的变异解 释更具有可信度,另一方面,将定向分析受检案例的病因情况的指标量化并进 行结合,在对受检案例的病因情况分析时,使得经由量化结合得到的变异解释 对应的检出遗传变异能够在众多病因变异的排列中置于更加显著的位置,从而 可以辅助分析人员进行分析推理,加快得出诊断结论的过程,提高变异排序结 果精确性和病因变异分析的效率。
[0243]
由于检出遗传变异的数量很大相应的得到的变异解释的数量也很大,所以, 在一种实施方式中,还可以对得到的各个变异解释进行排序,将最大值确定为 该检出遗传变异的变异解释,请继续参考图1。
[0244]
如图1所示,本技术实施例所提供的变异解释获取方法还可以包括:
[0245]
步骤s05,确定各个所述变异解释的最大值,得到所述检出遗传变异对应 的变异解释。
[0246]
这样,将变异解释中排序最前,定量化最大的变异解释作为所述检出遗传 变异的变异解释,可以保证该变异解释对应的检出遗传变异对受检案例的病因 情况分析中是有生物学意义的,能够为后续分析人员在临床诊断时提供可靠的 判断依据,加快分析人员的分析效率。
[0247]
为了能够方便理解根据所述变异组合获得变异致病性、疾病相似性、孟德 尔遗传一致性的过程,本技术实施例提供了以下实施例进行说明。
[0248]
在一种实施方式中,为了能够更方便的获得变异致病性,可以根据数据库 进行查询获得,具体的请参考图3,图3是本技术实施例提供的变异解释获取 方法中变异致病性获取方法的一流程示意图。
[0249]
如图3所示,本技术实施例提供的变异解释获取方法,可以包括以下步骤:
[0250]
步骤s30,根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式 获取与所述检出遗传变异相关的各个变异证据。
[0251]
为获得变异致病性,应在acmg指南及其衍生细化指南的框架下收集与该 检出遗传变异相关的变异证据,再按使用者需求根据不同的方法进行致病性判 定与变异致病性的计算。
[0252]
具体的变异证据及其相关内容可以参考图4所示,图4为变异证据及其内 容的示意图。
[0253]
当然,图4所示仅为参考举例说明的部分变异证据的介绍。可以看到,图 4中变异证据首先分为致病和良性两类变异证据,每一个变异证据都对应有变 异强度,即表明了变异证据对应的检出遗传变异导致受检案例生病的强度或概 率。将每个变异证据对应的变异强度都做出相应的编码标记,如图4所示的变 异强度为非常强的情况下,其编码为pvs1,即表示在出现了pvs1编码时,就 可以知道该偏移证据的变异强度为非常强,对应的内容可以查找图4得到对 pvs1的解释:该检出遗传变异为无义突变、移码突变、经典剪接位点正负1/2 位突变、起始密码子突变、单个或多个外显子缺失,且功能丧失是变异所在基 因的致病机制。
[0254]
这样,可以快速方便的得到各个变异证据对应的变异强度以及所表示的对 应于该检出遗传变异的具体内容。
[0255]
步骤s31,确定各个所述变异证据对应的变异强度,并确定各个所述变异 强度对应的所述变异证据的数量,得到变异证据数量。
[0256]
基于前一步确定的变异证据,获取对应的变异强度,进而对相同的变异强 度进行数量统计,得到变异强度数量。
[0257]
变异证据数量中包含有所述检出遗传变异的各个变异证据以及对应的变异 强度,用于后续致病强度的确定使用。
[0258]
步骤s32,根据所述变异证据数量获得所述变异致病性。
[0259]
为了基于变异证据数量得到变异致病性,可以首先基于变异证据数量获取 致病强度,然后基于致病强度获取变异致病性。
[0260]
具体地,各个变异证据数量和其对应的致病强度可以参考图5所示,图5 为变异证据数量与致病强度关系表。
[0261]
由于根据检出遗传变异获得到的变异证据的数量为多个,因此将各个变异 证据进行结合,然后通过查找图5所示的各个变异证据数量对应的组合方式, 进而得到致病强度。
[0262]
例如,根据检出遗传变异获得的变异证据为非常强变异证据(pvs1)和强 证据(ps1-ps4),对应的数量均为1项,则根据图5所示的证据数量查找对应 的致病强度,可以得知该变异证据数量的致病强度为:致病。
[0263]
这样,能够在基于检出遗传变异的基础上获得对应的变异证据从而得到致 病强度,最终获得变异致病性,可以使得变异致病性在分析检出遗传变异的变 异解释时支撑度更强。
[0264]
得到致病强度后,需进一步根据致病强度确定变异致病性,为了方便根据 致病强度确定变异致病性,在一种实施方式中,可以根据致病强度和变异致病 性相互间的对应关系来确定,具体的,可以包括:
[0265]
获取致病性对应表,所述致病性对应表包括各个致病强度对应的变异致病 性;
[0266]
根据所述致病性对应表确定所述致病强度对应的所述变异致病性。
[0267]
其中,所述致病性对应表可以参考图6,图6是致病性对应表的示意图。
[0268]
继续以前述案例进行说明,根据图5所示的证据数量查找对应的致病强度, 可以得知该变异证据数量的致病强度为:致病,进一步的根据图6所示的致病 性对应表查找到致病对应的变异致病性为0.99,则最终根据所述检出遗传变异 得到变异致病性为0.99。
[0269]
这样,通过查表的方式,能够快速得到变异致病性,并且将对受检案例病 因情况做定性分析的变异致病指标重新设计为量化的变异致病性,即变异致病 性并不是定性评价的致病或非致病的结论而是一个表示致病或非致病的量化数 值,为后续获取变异解释提供量化的数据基础。
[0270]
在另一些具体实施方式中,还可以根据acmg分级的贝叶斯量化方法得到 变异致病性。具体的,请参考图7,图7为本技术实施例提供的变异解释获取 方法中变异致病性获取方法的另一流程示意图。
[0271]
如图7所示,该流程可以包括以下步骤:
[0272]
步骤s40,根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式 获取与所述检出遗传变异相关的各个变异证据。
[0273]
步骤s40的具体内容与步骤s30的内容基本相同,在此不再赘述。
[0274]
步骤s41,确定各个所述变异证据对应的变异强度,并确定各个所述变异 强度对应的所述变异证据的数量,得到变异证据数量。
[0275]
步骤s41的具体内容与步骤s31的内容基本相同,在此不再赘述。
[0276]
步骤s42,根据所述变异证据数量利用致病机会函数得到联合致病机会。
[0277]
所述致病机会函数(odds of pathogenicity)用op进行表示,其公式可以表 示为:
[0278]
[0279]
其中,o
pvst
表示将各个变异强度联合转化为非常强变异强度(pvst)(各 个变异强度之间可以互相成指数幂转化,因此此处将各个变异强度均转化为最 强变异强度),psu表示变异证据对应的变异强度为支持变异强度,pm表示中 等变异强度,pst表示强变异强度,pvst表示非常强变异强度,n表示各个变 异强度对应的变异证据的数量,x表示各个变异证据在进行转化时使用的指数 幂,根据实际需要确定。
[0280]
具体的,可以参考图8所示,图8是致病机会函数的使用结果示意图。
[0281]
以图8中第一行数据进行说明,可以看到第一行数据中,变异证据数量表 项里包括的内容是:1项非常强证据(pvs)加至少1项强证据(ps1-ps4), 因此,在上述公式中的指数里的内容即为:
[0282][0283]
这里将强变异证据设定为2个,非常强变异证据设定为1个,x取值为2。
[0284]
步骤s43,利用所述联合致病机会、致病先验概率获得所述变异致病性, 其中,所述致病先验概率根据所述变异强度确定。
[0285]
得到联合致病机会后,进一步结合致病先验概率,获取变异致病性。
[0286]
继续以图8中的第一行数据作为示例进行说明。
[0287]
需要说明的是,在将所述联合致病机会、致病先验概率获得所述变异致病 性时所使用的公式为:
[0288][0289]
其中,post_p表示变异致病性,oddspath表示联合致病机会(即为根据前 述致病机会函数op获得的指标)prio_p表示致病先验概率,在这里将变异强 度设定为非常强变异强度,对应的致病先验概率可以根据图9所示示意图获取, 图9是非常强变异强度与致病先验概率关系示意图。
[0290]
利用上述致病机会函数和所述变异致病性计算公式根据图8的第一行数据 进行变异致病性的计算,具体表示为:
[0291]
首先,计算联合致病机会。
[0292]
在这里,将非常强变异强度的取值设定为350,则图8第一行的联合致病 机会根据致病机会函数op获得的过程可以表示为:
[0293][0294]
计算得到联合致病机会为6548。
[0295]
然后,根据联合致病机会、致病先验概率利用变异致病性计算公式计算变 异致病性,致病先验概率可以根据图9查找,由于将变异强度设定为350,因 此对应的致病先验概率值为0.1,具体为:
[0296][0297]
计算得到变异致病性为0.999。
[0298]
这样,就可以将原本定性评级的变异致病强度转化为定量化的且为基于检 出遗传变异获得的变异致病性,为后续组成变异解释提供有力的数据基础。
[0299]
除了获取变异致病性,还需要获取疾病相似性,接下来,对疾病相似性的 获取进行说明,在一种实施方式中,所述疾病相似性可以根据杰卡德相似系数 极性计算,具体的请参考图10,图10是本技术实施例提供的变异解释获取方 法中疾病相似性的获取步骤的一流程示意图。
[0300]
如图10所示,该流程可以包括以下步骤:
[0301]
步骤s50,根据所述受检案例在所述疾病下表现的各个表征获取各个受检 案例表征组。
[0302]
即将所述受检案例的临床表现(表征)构成标准表型组,设定为p,p中 的每一个元素即受检案例的表征对应人类表型本体数据库hpo数据库中的一 个条目编号,为后续计算提供数据基础。
[0303]
需要说明的是,所述受检案例表征组包括的表征可以是使用表征对应的专 用术语表示,也可以是其他标号,可以清楚表明该表征即可。
[0304]
这里以假设p中包含的元素为{表征1;表征2}为例进行后续说明的使用, 当然,这里仅做实例说明,具体包括的元素根据实际需要确定。
[0305]
步骤s51,根据人类表型本体数据库获取任一疾病表征组,所述任一疾病 表征组包括人类疾病中任一疾病表现的所有的标准疾病表征。
[0306]
人类表型本体数据库中包含有人类所存在所有疾病对应的所有临床表现, 根据人类表型本体数据库提供的疾病表型注释信息可得到每一种疾病(这里指 遗传疾病)的所有表征,将所有的表征组成的组合标记为d,则任一疾病表征 组表示为di,包括了任一疾病表现的所有的标准疾病表征。
[0307]
当然,任一疾病表征术语组包括的表征同样也可以是使用该表征对应的专 用术语表示,也可以是其他标号,可以清楚表明该表征即可。
[0308]
这里假设di中包含的元素为{标准表征1;标准表征2;标准表征3}为例进 行后续说明的使用,当然,这里仅做实例说明,具体包括的元素根据实际需要 确定。
[0309]
步骤s52,根据所述受检案例表征组和所述任一疾病表征组分别获取对应 的受检案例表征关联集和标准疾病表征关联集,所述受检案例表征关联集包括 所述受检案例表征和与所述受检案例表征相关联的子受检案例表征,所述标准 疾病表征关联集包括所述标准疾病表征和与所述标准疾病表征相关联的子标准 疾病表征。
[0310]
具体的,在获取所述受检案例表征关联集和标准疾病表征关联集时可以定 义收集函数s=f(t),其中t表示任一表征,使用算法自动化实现受检案例表 征关联集和标准疾病表征关联集的获取。
[0311]
所述受检案例表征关联集可以定义为p,假设p包括的元素为{表征1;子 表征11;子表征12}、{表征2;子表征21;子表征22}。
[0312]
所述标准疾病表征关联集可以定义为di,di包括的元素为{标准表征1;子 标准表征11};{标准表征2;子标准表征21;子标准表征22}、{标准表征3; 子标准表征31}。
[0313]
当然,上述举例均为方便说明计算过程,具体使用时根据实际情况确定。
[0314]
步骤s53,利用不同的排列规则对所述受检案例表征关联集和所述标准疾 病表征
关联集进行排列组合,得到各个所述排列规则对应的排列关联对。
[0315]
排列规则可以包括多种,例如将标准疾病表征关联集p中的各个元素集按 照对应的排列顺序,逐个单次的和标准疾病表征关联集di中的元素集对应做组 合,得到的排列关联对可以表示为:
[0316]
{表征1;子表征11;子表征12}与{标准表征1;子标准表征11}、{表征2; 子表征21;子表征22}与{标准表征2;子标准表征21;子标准表征22}。
[0317]
将排列规则定为:将标准疾病表征关联集p中的每一个元素与标准疾病表 征关联集di中对应排列位置的元素的下一个相邻排列位置处的元素做组合,得 到的排列关联对可以表示为:
[0318]
{表征1;子表征11;子表征12}与{标准表征2;子标准表征21;子标准 表征22}、{表征2;子表征21;子表征22}与{标准表征3;子标准表征31}。
[0319]
这样可以根据不同的排列规则得到不同的排列关联对,排列规则越多得到 的排列关联对也就越多,进而计算杰卡德相似系数时的数据也就更充分,计算 的结果更准确。
[0320]
步骤s54,根据各个所述排列关联对确定对应的排列杰卡德相似系数。
[0321]
以上述两个排列规则得到的排列关联对进行说明。
[0322]
可以知道排列规则不同得到的排列关联对也就不同,因此需要计算每一个 排列规则下的得到的排列关联对。
[0323]
在一种实施方式中,所述根据各个所述排列关联对确定对应的排列杰卡德 相似系数的步骤包括:
[0324]
确定各个所述排列关联对中的当前排列关联对;
[0325]
根据所述当前排列关联对中包括的各个所述受检案例表征关联集和所述标 准疾病表征关联集的组合对,分别计算各个所述组合对的杰卡德相似系数;
[0326]
加和各个所述组合对的杰卡德相似系数,得到所述当前排列关联对的杰卡 德相似系数;
[0327]
将各个所述排列关联对中的其他排列关联对确定为新的当前排列关联对, 直至得到所有的所述排列杰卡德相似系数。
[0328]
为了方便理解,首先,以上述第一种排列规则:将标准疾病表征关联集p 中的各个元素顺序单次的和标准疾病表征关联集di中的元素做组合,得到的排 列关联对可以表示为:
[0329]
{表征1;子表征11;子表征12}与{标准表征1;子标准表征11}、{表征2; 子表征21;子表征22}与{标准表征2;子标准表征21;子标准表征22}为例。
[0330]
即确定当前排列关联对。
[0331]
然后,根据所述当前排列关联对中包括的各个所述受检案例表征关联集和 所述标准疾病表征关联集的组合对即:{表征1;子表征11;子表征12}与{标 准表征1;子标准表征11}、{表征2;子表征21;子表征22}与{标准表征2; 子标准表征21;子标准表征22},分别计算各个所述组合对的杰卡德相似系数;
[0332]
需要说明的是,杰卡德相似系数是一种用于衡量集合间元素相似程度的指 标。设集合a与集合b,其交集的元素个数为|a∩b|,其并集的元素个数为|a ∪b|,则,jsc=(|a∩b|)/(|a∪b|)。
[0333]
集合a既可以视为前述第一个组合对中的{表征1;子表征11;子表征12}, b可以视为前述第一个组合对中的{标准表征1;子标准表征11},则对应该组 合对的杰卡德相似系数计算表示为:
[0334]
jsc1=(|{表征1;子表征11;子表征12}∩{标准表征1;子标准表征11}|)/ (|{表征1;子表征11;子表征12}∪{标准表征1;子标准表征11}|)。
[0335]
同理可以计算下一个组合对的杰卡德相似系数:
[0336]
jsc2=(|{表征2;子表征21;子表征22}∩{标准表征2;子标准表征21; 子标准表征22}|)/(|{表征2;子表征21;子表征22}∪{标准表征2;子标准表 征21;子标准表征22}|)。
[0337]
接着,将上述两个杰卡德相似系数加和得到该排列规则对应的杰卡德相似 系数。
[0338]
最后,将各个所述排列关联对中的其他排列关联对确定为新的当前排列关 联对,直至得到所有的所述排列杰卡德相似系数。
[0339]
步骤s55,确定各个所述排列杰卡德相似系数中的最大相似系数,根据所 述最大相似系数获得所述疾病相似性。
[0340]
这样,根据最大相似系数得到的疾病相似性可以更加准确可靠。
[0341]
基于上述介绍可以知道所述排列杰卡德相似系数根据不同的排列规则是由 不同的数值的,因此,为了确保最终确定使用的杰卡德相似系数的准确性,需 要对各个所述排列杰卡德相似系数进行排序,具体的,该步骤可以包括:
[0342]
确定所述受检案例表征组中包含的表征数量和所述任一疾病表征组中包含 的表征数量的最大值;
[0343]
对所述最大值取倒数得到所述最大值相似系数。
[0344]
任然以前述标准疾病表征关联集p和标准疾病表征关联集di为例,则最大 值即为:max(count(p),count(di))=max(2,3)=3。
[0345]
则所述最大相似系数为:1/3。
[0346]
这样,可以确保最终用于获得疾病相似性的最大相似系数对分析受检案例 病因情况是最有用的。
[0347]
最后,为方便获取孟德尔遗传一致性,以下对所述孟德尔遗传一致性进行 说明。
[0348]
请参考图11,图11是本技术实施例提供的变异解释获取方法中孟德尔遗 传一致性的获取方法的一流程示意图。
[0349]
如图中所示,该流程可以包括以下步骤:
[0350]
步骤s60,获取所述遗传模式。
[0351]
步骤s61,确定所述遗传模式是否为显性遗传模式,是则执行步骤s62, 否则执行步骤s64。
[0352]
由于显性遗传模式中对应的基因为显性基因,因此只要包含有该显性基因 则一定会出现对应的遗传模式下的表型,即步骤s62,直接考虑该检出遗传变 异对应的变异组合的孟德尔遗传一致性即可,不会遗漏对于该显性遗传模式下 的基因的孟德尔遗传一致性的判断与获得,但是在隐性遗传模式下,对应的基 因为隐性基因,存在该基因的两个不同变异以复合杂合形式致病的情况,这样 就会造成对于该隐性基因的孟德尔遗传一致性获取的不全面性,会影响对于该 隐性遗传模式下的隐性基因的孟德尔遗传一致性的判断,
因此需要考虑同属于 一个基因下的其他检出遗传变异中对于该检出遗传变异对应的隐性基因的孟德 尔遗传一致性,即步骤s64。
[0353]
步骤s62,根据所述显性遗传模式对应的孟德尔遗传合性确定所述检出遗 传变异对应的受检案例及其家庭成员的孟德尔遗传符合值。
[0354]
步骤s63,将各个所述孟德尔遗传符合值结合得到所述孟德尔遗传一致性。
[0355]
这样,在确定了遗传模式为显性遗传模式时,可以仅仅考虑该检出遗传变 异本身即可确定孟德尔遗传一致性,使得孟德尔遗传一致性的结果更加可靠, 为后续获得变异解释提供可靠的数据基础。
[0356]
在一种实施方式中,为了方便计算孟德尔遗传一致性,步骤s62可以包括 以下步骤,请参考图12,图12是本技术实施例所提供的变异解释获取方法中 孟德尔遗传一致性的获取方法的另一流程示意图。
[0357]
如图12所示,该流程可以包括以下步骤:
[0358]
步骤s620,根据所述检出遗传变异对应的受检案例确定所述受检案例的各 个家庭成员的受累状况。
[0359]
基于前述对受累状况的解释,可以知道是用于表示受检案例以及其家人的 患病情况,即受检案例的家人是否出现与受检案例一样的疾病表征。
[0360]
这里假设受检案例的父亲和母亲的受累情况均为正常,当然所述受检案例 的受累情况为患病。
[0361]
步骤s621,根据各个所述受累状况和所述疾病对应的所述显性遗传模式确 定所述受检病例和各个所述家庭成员对该所述检出遗传变异的实测基因型。
[0362]
实测基因型为根据受检案例以及家庭成员的实际患病情况测得的基因型, 基因型即为根据该遗传模式下的基因表达式,设定该疾病为狄兰吉氏症候群 (cornelia de lange syndrome 5),继续以前述受检案例的父亲和母亲的受累情 况均为正常,所述受检案例的受累情况为患病为例进行说明,根据该受累情况, 其母亲的实测基因型为:xaxa,父亲的实测基因型为:xay,患病(假定受检 案例为女孩)的实测基因型为:xaxa,当然基因表达式仅作为事例说明,具 体以实际情况为参考。
[0363]
步骤s622,根据所述疾病对应的所述显性遗传模式确定对应的标准基因型。
[0364]
例如基于前述疾病为狄兰吉氏症候群(cornelia de lange syndrome 5),其 对应的是x染色体连锁性的遗传模式,这样根据该遗传模式可以知道对应的标 准基因型,即x染色体连锁性的遗传模式下的患者的标准基因型为:女孩为 xaxa或xaxa,男孩为xay,未患病即正常的标准基因型:女孩xaxa和男 孩xay。
[0365]
步骤s623,逐个对比各个所述实测基因型和所述标准基因型的受累状况是 否相符合,相符合则将该实测基因型对应的孟德尔遗传符合值计为1,不符合 则将所述孟德尔遗传符合值下降一个数量级。
[0366]
这一步即为将前述的实测基因型:母亲的实测基因型为:xaxa,父亲的实 测基因型为:xay,患病的实测基因型为:xaxa和标准基因型:患者的标准 基因型为:女孩为xaxa或xaxa,男孩为xay,未患病即正常的标准基因型: 女孩xaxa和男孩xay最对比,看父母和受检案例的基因型与标准基因型是否 一致。
[0367]
可以看到,受检案例和父亲和母亲的实测基因型是符合该疾病对应的遗传 模式
下的标准基因型的。则对应的单人孟德尔遗传一致性均为1。
[0368]
步骤s63可以包括:
[0369]
步骤s624,直至对比完全部的所述实测基因型,将各个所述孟德尔遗传符 合值相乘得到所述孟德尔遗传一致性。
[0370]
继续以前述案例说明,前述已经确定受检案例和其父母对应的单人孟德尔 遗传一致性均为1,因此该受检案例的孟德尔遗传异质性为:1
×1×
1=1。
[0371]
这样,根据综合考虑了受检案例和其父母的患病情况下,得到的量化的孟 德尔遗传一致性能够更具有生物学意义。
[0372]
当确定所述遗传模式为隐性遗传模式时,此时不仅需要考虑该检出遗传变 异本身的孟德尔遗传一致性还要考虑与该检出遗传变异同属于一个基因的其他 检出遗传变异针对于该检出遗传变异的孟德尔遗传一致性,这样,可以全面考 虑该隐性基因所包括的孟德尔遗传一致性,曾强对于隐性遗传模式下的该检出 遗传变异所对应的孟德尔遗传一致性的可靠性和准确性。
[0373]
具体的,当确定遗传模式不是显性遗传时,请继续参考图11,如图11所 示,该流程还可以包括:
[0374]
步骤s64,确定所述隐性遗传模式对应的基因,根据所述基因确定不同于 所述检出遗传变异的各个其他检出遗传变异,将所述检出遗传变异分别与各个 其他检出遗传变异组合得到组合变异对。
[0375]
为方便说明,将该隐性遗传模式下对应的基因设定为a,其同一基因即该 基因a的等位基因设定为a。
[0376]
为了全面获取a的孟德尔遗传一致性,需要考虑该基因a的等位基因a对 应的所有的其他检出遗传变异,从而获得该检出遗传变异分别与其他检出遗传 变异组合得到的组合变异对的孟德尔遗传一致性。
[0377]
步骤s65,根据所述隐性遗传模式对应的孟德尔遗传合性确定所述检出遗 传变异所对应的受检案例及其家庭成员的检出遗传变异孟德尔遗传符合值。
[0378]
这一步可以根据前述步骤s62的内容得到各个所述检出遗传变异孟德尔遗 传符合值。
[0379]
步骤s66,根据所述隐性遗传模式对应的孟德尔遗传合性确定各个所述组 合变异对所对应的受检案例及其家庭成员的组合变异对孟德尔遗传符合值。
[0380]
所述组合变异对的孟德尔遗传符合值根据各个组合变异对内包括的所述检 出遗传变异的基因型和所述其他检出遗传变异的基因型结合得到的基因型(可 以包括:复合杂合基因型)判断所述受检案例及其家庭成员是否符合孟德尔遗 传合性,符合则确定该组合变异对的组合变异对孟德尔遗传符合值为1,不符 合则将组合变异对孟德尔遗传符合值下降一个数量级。
[0381]
步骤s67,将各个所述检出遗传变异孟德尔遗传符合值结合得到检出遗传 变异孟德尔遗传一致性。
[0382]
这一步中获取该检出遗传变异的检出遗传变异孟德尔遗传一致性可以参考 步骤s62的内容,假设所述检出遗传变异孟德尔遗传一致性为1。
[0383]
步骤s68,将各个所述组合变异对孟德尔遗传符合值结合得到各个组合变 异对孟
德尔遗传一致性。
[0384]
对于各个所述变异组合对获得变异组合对孟德尔遗传一致性可以为:
[0385]
假设该检出遗传变异对应的基因a,同属于同一基因的a所对应的其他检 出遗传变异为:检出遗传变异1、检出遗传变异2,则分别获得各个其他检出遗 传变异与所述检出遗传变异组合得到的变异组合对的孟德尔遗传一致性。
[0386]
首先计算检出遗传变异1下的组合变异对孟德尔遗传一致性:
[0387]
组合变异对1:{检出遗传变异,检出遗传变异1},即检出遗传变异对应的 基因型和检出遗传变异1对应的基因型组成的组合变异对下的所述受检案例及 其家庭成员的各个组合变异对孟德尔遗传符合值,假设{检出遗传变异,检出遗 传变异1}的组合变异对孟德尔遗传一致性为0.01。
[0388]
同理,计算检出遗传变异2下的组合变异对孟德尔遗传一致性:
[0389]
组合变异对2:{检出遗传变异,检出遗传变异2},同样是计算检出遗传变 异对应的基因型和检出遗传变异2对应的基因型组成的组合变异对下的受检案 例及其家庭成员的各个组合变异对孟德尔遗传符合值,假设{检出遗传变异,检 出遗传变异2}的组合变异对孟德尔遗传一致性为0.1。
[0390]
为方便理解,继续以前述基因a为例,当所述检出遗传变异对应的受检案 例的基因型为aa(即杂合子)时,受检案例与所述检出遗传变异的遗传模式是 不符合孟德尔遗传规律的,因此考虑该基因对应的其他检出遗传变异下对应于 该检出遗传变异的基因型,即组合变异对1:{检出遗传变异,检出遗传变异1} 的基因型,在一种具体实施方式中:
[0391]
当所述受检案例对于组合变异对1:{检出遗传变异,检出遗传变异1}的基 因型为{杂合子,杂合子}的复合杂合子时,其对应的基因型即为a对应的等位 基因a1,因此,此时的复合杂合基因型为aa1,此时受检案例的受累状况即为 符合孟德尔遗传规律的(隐性遗传),对应于该受检案例的组合变异对孟德尔 遗传符合值即为1。
[0392]
步骤s69,确定所述检出遗传变异孟德尔遗传一致性和各个所述组合变异 对孟德尔遗传一致性中的最大值作为所述检出遗传变异对应的孟德尔遗传一致 性。
[0393]
继续以上述例子进行说明,上述所述检出遗传变异孟德尔遗传一致性为1、 组合变异对1对应的组合变异对孟德尔遗传一致性为0.01和组合变异对2对应 的组合变异对孟德尔遗传一致性为0.1。
[0394]
确定检出遗传变异孟德尔遗传一致性最大,即确定该隐性遗传模式下的孟 德尔遗传一致性为1。
[0395]
这样,使得最终获得到的该遗传模式下的孟德尔遗传一致性的数据更加全 面准确。
[0396]
为了解决前述问题,本技术实施例还提供一种变异解释获取装置,该装置 可以认为是实现本技术实施例提供的变异解释获取方法所需设置的功能模块。 下文描述的装置内容可与上文描述的方法内容相互对应参照。
[0397]
作为一种可选实现中,图13示出了本技术实施例提供的变异解释获取装置 的可选框图。如图13所示,该装置适于获取检出遗传变异对受检案例的变异解 释,可以包括:
[0398]
检出遗传变异获取模块80,适于获取所述受检案例的检出遗传变异。
[0399]
变异组合获取模块81,适于基于所述检出遗传变异,获取所述检出遗传变 异对应
的变异组合,所述变异组合包括所述检出遗传变异、所述检出遗传变异 对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式。
[0400]
在一种实施方式中,所述变异组合获取模块81适于:
[0401]
基于所述检出遗传变异,获取所述检出遗传变异对应的各个基因;
[0402]
获取各个所述基因对应的疾病;
[0403]
根据各个所述疾病,得到对应的遗传模式;
[0404]
将相互对应的所述检出遗传变异、所述基因、所述疾病和所述遗传模式进 行组合,得到各个所述变异组合。
[0405]
指标获取模块82,适于根据所述变异组合中的所述检出遗传变异、所述检 出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取 所述检出遗传变异的变异致病性、与所述疾病对应的疾病相似性和与所述遗传 模式对应的孟德尔遗传一致性三者中的至少两者。
[0406]
在一种具体实施方式中,所述指标获取模块82适于据所述变异组合中的所 述检出遗传变异、所述检出遗传变异对应的基因、所述基因对应的疾病及所述 疾病对应的遗传模式获取所述检出遗传变异的变异致病性、与所述疾病对应的 疾病相似性和与所述遗传模式对应的孟德尔遗传一致性三者中的至少两者,包 括:
[0407]
确定各个变异组合中的当前变异组合;
[0408]
执行以下步骤中的至少两者,获取所述变异致病性、所述疾病相似性和所 述孟德尔遗传一致性三者中的至少两者:
[0409]
根据所述当前变异组合中的所述检出遗传变异、所述基因、所述疾病和所 述遗传模式获得当前变异致病性;
[0410]
根据所述当前变异组合中的所述疾病获得当前疾病相似性;
[0411]
至少根据所述当前变异组合中的所述检出遗传变异和所述遗传模式获得当 前孟德尔遗传一致性。
[0412]
变异解释获取模块83,适于根据所述变异致病性、所述疾病相似性和所述 孟德尔遗传一致性三者中所获取的至少两者获取所述变异组合的所述变异解释。
[0413]
在一种具体实施方式中,所述变异解释获取模块83,还适于:
[0414]
确定各个所述变异解释的最大值,得到所述检出遗传变异对应的变异解释。
[0415]
当所述指标获取模块82获取当前变异组合的变异解释时,所述变异解释获 取模块83适于根据所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性 三者中所获取的至少两者获取所述变异组合的所述变异解释,包括:
[0416]
根据所述当前变异致病性、所述当前疾病相似性和所述当前孟德尔遗传一 致性三者中所获取的至少两者获取所述当前变异组合的当前变异解释,直至得 到各个所述变异组合对应的各个所述变异解释。
[0417]
在一种具体实施方式中,所述变异解释获取模块83,适于根据所述变异致 病性、所述疾病相似性和所述孟德尔遗传一致性三者中所获取的至少两者获取 所述变异组合的所述变异解释,包括:
[0418]
通过对所述变异致病性、所述疾病相似性和所述孟德尔遗传一致性三者中 所获取的至少两者进行叉乘得到变异解释。
[0419]
在获取所述变异致病性时,所述指标获取模块82适于根据所述变异组合中 的所述检出遗传变异、所述检出遗传变异对应的基因、所述基因对应的疾病及 所述疾病对应的遗传模式获取所述检出遗传变异的变异致病性,包括:
[0420]
根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
[0421]
根据各个所述变异证据确定各个所述变异证据对应的致病强度,根据所述 致病强度获得所述变异致病性。
[0422]
其中,在一种实施方式中,所述指标获取模块82,适于根据所述变异证据 数量获得所述变异致病性,包括:
[0423]
根据所述证据数量确定致病强度;
[0424]
获取致病性对应表,所述致病性对应表包括各个致病强度对应的变异致病 性;
[0425]
根据所述致病性对应表确定所述致病强度对应的所述变异致病性。
[0426]
在另一些实施方式中,为了获取变异致病性,所述指标获取模块82,适于 根据所述变异组合中的所述检出遗传变异、所述检出遗传变异对应的基因、所 述基因对应的疾病及所述疾病对应的遗传模式获取所述检出遗传变异的变异致 病性,包括:
[0427]
根据所述检出遗传变异、所述基因、所述疾病和所述遗传模式获取与所述 检出遗传变异相关的各个变异证据;
[0428]
根据各个所述变异证据确定对应的致病强度,并根据各个所述致病强度确 定每个致病强度对应的所述变异证据的数量;
[0429]
根据所述变异证据的数量利用致病机会函数得到联合致病机会;
[0430]
利用所述联合致病机会、致病先验概率获得所述变异致病性,其中,所述 致病先验概率根据所述变异强度确定。
[0431]
其中,在一些实施方式中,所述变异强度包括非常强变异强度,所述致病 先验概率根据所述变异强度确定,包括:
[0432]
确定所述变异强度为非常强变异强度;
[0433]
根据所述非常强变异强度确定所述致病先验概率。
[0434]
为了获取疾病相似性,在一种具体实施方式中,所述指标获取模块82,适 于根据所述变异组合中的所述检出遗传变异、所述检出遗传变异对应的基因、 所述基因对应的疾病及所述疾病对应的遗传模式获取与所述疾病对应的疾病相 似性,包括:
[0435]
根据所述受检案例在所述疾病下表现的各个表征获取各个受检案例表征组;
[0436]
根据人类表型本体数据库获取任一疾病表征组,所述任一疾病表征组包括 人类疾病中任一疾病表现的所有的标准疾病表征;
[0437]
根据所述受检案例表征组和所述任一疾病表征组分别获取对应的受检案例 表征关联集和标准疾病表征关联集,所述受检案例表征关联集包括所述受检案 例表征和与所述受检案例表征相关联的子受检案例表征,所述标准疾病表征关 联集包括所述标准疾病表征和与所述标准疾病表征相关联的子标准疾病表征;
[0438]
利用不同的排列规则对所述受检案例表征关联集和所述标准疾病表征关联 集进行排列组合,得到各个所述排列规则对应的排列关联对;
[0439]
根据各个所述排列关联对确定对应的排列杰卡德相似系数;
[0440]
确定各个所述排列杰卡德相似系数中的最大相似系数,根据所述最大相似 系数获得所述疾病相似性。
[0441]
其中,在一种具体实施方式中,所述指标获取模块82,适于根据各个所述 排列关联对确定对应的排列杰卡德相似系数,包括:
[0442]
确定各个所述排列关联对中的当前排列关联对;
[0443]
根据所述当前排列关联对中包括的各个所述受检案例表征关联集和所述标 准疾病表征关联集的组合对,分别计算各个所述组合对的杰卡德相似系数;
[0444]
加和各个所述组合对的杰卡德相似系数,得到所述当前排列关联对的杰卡 德相似系数;
[0445]
将各个所述排列关联对中的其他排列关联对确定为新的当前排列关联对, 直至得到所有的所述排列杰卡德相似系数。
[0446]
在一种实施方式中,所述确定模块82适于获取最大相似系数的步骤包括:
[0447]
确定所述受检案例表征组中包含的表征数量和所述任一疾病表征组中包含 的表征数量的最大值;
[0448]
对所述最大值取倒数得到所述最大相似系数。
[0449]
为了获取孟德尔遗传一致性,在一种实施方式中,所述指标获取模块82, 适于根据所述变异组合中的所述检出遗传变异、所述检出遗传变异对应的基因、 所述基因对应的疾病及所述疾病对应的遗传模式获取与所述遗传模式对应的孟 德尔遗传一致性,包括:
[0450]
当确定所述遗传模式为显性遗传模式时,根据所述显性遗传模式对应的孟 德尔遗传合性确定所述检出遗传变异对应的受检案例及其家庭成员的孟德尔遗 传符合值;
[0451]
将各个所述孟德尔遗传符合值结合得到所述孟德尔遗传一致性。
[0452]
为了方便获取所述孟德尔遗传一致性,在一种实施方式中,所述指标获取 模块,适于根据所述显性遗传模式对应的孟德尔遗传合性确定所述受检案例及 其家庭成员的孟德尔遗传符合值,包括:
[0453]
根据所述检出遗传变异对应的受检案例确定所述受检案例的各个家庭成员 的受累状况;
[0454]
根据各个所述受累状况和所述疾病对应的所述显性遗传模式确定所述受检 病例和各个所述家庭成员对该所述检出遗传变异的实测基因型;
[0455]
根据所述疾病对应的所述显性遗传模式确定对应的标准基因型;
[0456]
逐个对比各个所述实测基因型和所述标准基因型的受累状况是否相符合, 相符合则将该实测基因型对应的孟德尔遗传符合值计为1,不符合则将所述孟 德尔遗传符合值下降一个数量级;
[0457]
所述指标获取模块,适于将各个所述孟德尔遗传符合值结合得到所述孟德 尔遗传一致性,包括:
[0458]
直至对比完全部的所述实测基因型,将各个所述孟德尔遗传符合值相乘得 到所述孟德尔遗传一致性。
[0459]
在另一种实施中,所述孟德尔遗传一致性的获取还可以为:
[0460]
所述指标获取模块适于根据所述变异组合中的所述检出遗传变异、所述检 出遗传变异对应的基因、所述基因对应的疾病及所述疾病对应的遗传模式获取 与所述遗传模
式对应的孟德尔遗传一致性,包括:
[0461]
当确定所述遗传模式为隐性遗传模式时,确定所述隐性遗传模式对应的基 因,根据所述基因确定不同于所述检出遗传变异的各个其他检出遗传变异,将 所述检出遗传变异分别与各个其他检出遗传变异组合得到组合变异对;
[0462]
根据所述隐性遗传模式对应的孟德尔遗传合性确定所述检出遗传变异所对 应的受检案例及其家庭成员的检出遗传变异孟德尔遗传符合值;
[0463]
根据所述隐性遗传模式对应的孟德尔遗传合性确定各个所述组合变异对所 对应的受检案例及其家庭成员的组合变异对孟德尔遗传符合值;
[0464]
将各个所述检出遗传变异孟德尔遗传符合值结合得到检出遗传变异孟德尔 遗传一致性;
[0465]
将各个所述组合变异对孟德尔遗传符合值结合得到各个组合变异对孟德尔 遗传一致性;
[0466]
确定所述检出遗传变异孟德尔遗传一致性和各个所述组合变异对孟德尔遗 传一致性中的最大值作为所述检出遗传变异对应的孟德尔遗传一致性。
[0467]
可以看出,本技术实施例所提供的变异解释获取装置,基于能够更有力的 解释受检案例的病因情况的检出遗传变异来获取对应的基因、所述基因对应的 疾病以及所述疾病对应的遗传模式,从而得到一个综合性变异组合,然后利用 变异组合将用于定性评价受检案例病因情况的变异致病性、疾病相似性、孟德 尔遗传一致性进行量化,将量化的变异致病性、疾病相似性、孟德尔遗传一致 性三者中的至少两者结合得到变异解释,这样,一方面,基于检出遗传变异得 到的变异解释可以提高对受检案例病因情况分析的准确度,使得获得的变异解 释更具有可信度,另一方面,将定向分析受检案例的病因情况的指标量化并进 行结合,在对受检案例的病因情况分析时,使得经由量化结合得到的变异解释 对应的检出遗传变异能够在众多病因变异的排列中置于更加显著的位置,从而 可以辅助分析人员进行分析推理,加快得出诊断结论的过程,提高变异排序结 果精确性和病因变异分析的效率。
[0468]
本技术实施例还提供一种电子设备,包括至少一个存储器91和至少一个处 理器92;所述存储器91存储有程序,所述处理器92调用所述程序,以执行如 前述任一项实施例所述的变异解释获取方法。
[0469]
如图14所示,图14是本技术实施例所提供的电子设备的示意图。
[0470]
可以理解的是,所述设备还可以包括至少一个通信接口93和至少一个通信 总线94;处理器92和存储器91可以位于同一电子设备,例如处理器92和存 储器91可以位于服务单元器设备或者终端设备;处理器92和存储器91也可以 位于不同的电子设备。
[0471]
在本技术所提供的实施例中,处理器92、通信接口93、存储器91、通信 总线94的数量为至少一个,且处理器92、通信接口93、存储器91通过通信总 线94完成相互间的通信;显然,图13所示的处理器92、通信接口93、存储器 91和通信总线94的通信连接示意仅是可选的一种方式。
[0472]
可选的,通信接口93可以为通信模块的接口,如gsm模块的接口;处理 器92可能是中央处理器cpu,或者是特定集成电路asic,或者是被配置成实 施本技术实施例的一个或多个集成电路;存储器91可以包含高速ram存储器, 也可以包括非易失性存储器,例如至少
一个磁盘存储器。
[0473]
需要说明的是,上述的设备还可以包括与本发明实施例公开内容可能并不 是必需的其他器件(未示出);鉴于这些其他器件对于理解本发明实施例公开 内容可能并不是必需,本发明实施例对此不进行逐一介绍。
[0474]
本技术实施例还提供一种存储介质,所述存储介质存储有适于获取变异解 释的程序,以实现如前述任一项实施例所述的变异解释获取方法。
[0475]
为了进一步理解本发明所提供的变异解释获取方法,本技术提供了两个具 体实施例(一个为显性遗传模式,另一个为隐性遗传模式)作为参考。
[0476]
变异解释(eps)的计算举例之一(案例来自国家卫生健康委临床检验 中心2021年遗传病高通量测序检测生信分析室间质评)
[0477]
受检案例的临床信息:“女,7岁,因
‘
发现发育迟缓3年’至门诊就诊。 现病史:患儿于3年前被发现生长发育迟缓,年身高增长不详,无头痛、无呕 吐,无多饮、多尿,伴智力低下,偶有大便失禁,小便正常。摄骨龄相当于5.2 岁,骨龄延迟》2sd,拟诊
‘
矮小症’。该患儿g2p1,足月剖宫产,出生身长 52cm,出生体重3100g,无窒息抢救史。父身高:172cm。母身高:158cm。患 儿母亲孕期产检提示有脑积水,未予特殊处理。喂养史:生后母乳喂养。添加 辅食时间:10月,饮食正常。生长发育史:7月抬头,12月能坐,16月会站, 18月扶走,18月说话,学习成绩一般。非近亲。否认家族遗传性或先天性病史。
”ꢀ
该案例经高通量测序及上游数据分析、过滤,得到候选变异792个,以其中的 1个为例展示eps的计算过程。
[0478][0479]
经注释可知,该变异位于基因hdac8,导致cdna水平的变异:c.295 3a》c。 经查询omim数据库(https://www.omim.org/),得知hdac8可导致疾病
ꢀ“
cornelia de lange syndrome 5”,该疾病以x染色体连锁显性(x-linkeddominant,xld)的遗传模式遗传。
[0480]
变异基因疾病遗传模式chrx-71788601-t-ghdac8cornelia de lange syndrome 5xld
[0481]
(1)变异致病性的计算(vps)。根据glingen机构gene-disease关联程 度工作组的研究结果,hdac8基因与疾病的关联程度为高,不需要调整判定 等级。该变异影响标准剪切位点,导致外显子跳跃,读码框改变,预测分析引 起无义突变介导的mrna降解,符合pvs1证据。该变异为新发变异,但表型 具有高度遗传异质性,符合ps2_supporting证据。该位点突变的等位基因频率 在gnomad等公共数据库和本地数据库人群频率缺失,符合pm2_supporting证 据。因此该变异被判定为“致病变异”,根据图6的信息,vps=0.99。
[0482]
(2)疾病相似性的计算(dss)。从该案例的临床信息中提取先证者的 标准表型为:hp:0001249intellectual disability;hp:0001263:global developmentaldelay;hp:0001270motor delay;hp:0002607bowel incontinence;hp:0003799 marked delay in bone age;hp:0004322short stature。查询hpo数据库得知, cornelia de lange syndrome 5对应标准表型为:hp:0008897postnatal growthretardation;hp:0001956truncal obesity;hp:0004322short stature;hp:0000175 cleft palate;hp:0002714downturned corners of mouth;hp:0000687widelyspaced teeth;等等。根据本
申请前述获得疾病相似性的方法可以得知,dss=0.06。
[0483]
(3)孟德尔遗传一致性(mcs)的计算。由受检案例的临床信息可得 知,先证者、先证者母亲、先证者父亲的受累状况分别为“患病”、“正常”、
ꢀ“
正常”。由检测结果得知,先证者、先证者母亲、先证者父亲的该变异的合 性分别为“杂合子”、“野生型”、“野生型”。由于该检出遗传变异对应的 疾病的遗传模式为xld,可知先证者、先证者母亲、先证者父亲的状况都符合 孟德尔遗传规律。以前述本技术实施例例举的孟德尔遗传一致性的获得方法, 则mcs=1
×1×
1=1。
[0484]
因此,deps=vps
×
dss
×
mcs=0.99
×
0.06
×
1=0.0594。
[0485]
因此,eps=max(deps)=0.0594。
[0486]
这样,就获得到了本技术所述的变异解释(eps)。
[0487]
变异解释(eps)的计算举例之二(案例来自国家卫生健康委临床检验中 心2020年遗传病高通量测序检测生信分析室间质评)
[0488]
受检案例的临床信息:“男,2月龄,因腹泻10余天间断发热入院。 患儿日解黄色稀水便10余次,偶有血丝,无粘液。血常规提示白细胞较高, 胃镜提示食管炎、浅表性胃炎,结肠镜检查提示肛周溃疡、结肠炎。病理检 查提示嗜酸细胞增多,考虑过敏性结肠炎。查体:体重4.56kg,皮下脂肪《0.8cm, 体重小于同年龄同性别儿童体重的第三百分位。目前诊断:1、结肠炎(过敏 性结肠炎),2、食管炎,3、营养不良,4、肺炎。家族史:患儿父母体健, 非近亲结婚,患儿有一哥哥生后2个月因反复发热、腹泻等后因医治无效死 亡。”[0489]
该案例经高通量测序及上游数据分析、过滤,得到候选变异699个,以 其中的1个为例展示eps的计算过程。
[0490][0491]
经注释可知,该变异位于基因il10ra,导致cdna水平的变异c.301c》t, 导致氨基酸序列的变异p.r101w。经查询omim数据库(https://www.omim.org/), 得知il10ra可导致疾病“inflammatory bowel disease 28”,该疾病以常染色体 隐性(autosomal recessive,ar)的遗传模式遗传。
[0492]
变异基因疾病遗传模式chr11-117860269-c-til10rainflammatory bowel disease 28ar
[0493]
(1)变异致病性的计算(vps)。该位点突变的等位基因频率在gnomad 等公共数据库和本地数据库人群频率缺失,符合pm2_supporting证据。因此该 变异被判定为“意义未明变异”,根据图6的信息,vps=0.5。
[0494]
(2)疾病相似性的计算(dss)。从该案例的临床信息中提取先证者的标 准表型为:hp:0002014diarrhea;hp:0001945fever;hp:0002583colitis; hp:0100633esophagitis;hp:0410151eosinophilic infiltration of the esophagus; hp:0001510growth delay。查询hpo数据库得知,inflammatory bowel disease 28 对应标准表型为:hp:0002573hematochezia;hp:0000155oral ulcer;hp:0004387 enterocolitis;hp:0100280crohn's disease;hp:0002583colitis; hp:0000999pyoderma;hp:0009789perianal abscess;hp:0025084folliculitis; hp:0001510growth delay。根据本
申请前述获得疾病相似性的方法可以得知, dss=0.25。
[0495]
(3)孟德尔遗传一致性(mcs)的计算。由受检案例的临床信息可得 知,先证者、先证者母亲、先证者父亲的受累状况分别为“患病”、“正常”、
ꢀ“
正常”。由检测结果得知,先证者、先证者母亲、先证者父亲的该变异的合 性分别为“杂合子”、“野生型”、“杂合子”。我们首先考察该变异单独作 为病因的可能性。由于该检出遗传变异对应的疾病的遗传模式为ar,可知先 证者的状况不符合孟德尔遗传规律,而先证者母亲、父亲的状况都符合孟德尔 遗传规律,以前述本技术实施例例举的孟德尔遗传一致性的获得方法,则 mcs=0.1
×1×
1=0.1。由于该检出遗传变异对应的疾病的遗传模式为ar,我们 还需要考虑该检出遗传变异与所在对应同一基因(il10ra)上的其他检出变异 组成变异对(即本技术前述{检出遗传变异,检出遗传变异1}或{检出遗传变异, 检出遗传变异2})以复合杂合形式作为病因的可能性。通过检索候选变异,我 们发现il10ra上还检出另一个变异,如下表所示。
[0496][0497]
因此,变异chr11-117860269-c-t一共可以生成1个变异对,由其本身与以 上chr11-117864125-g-a组成,即(chr11-117860269-c-t,chr11-117864125-g-a)。
[0498]
该变异对在受检案例中的基因型如下表所示。
[0499][0500]
由于遗传模式为ar且先证者、先证者母亲、先证者父亲的受累状况分别 为“患病”、“正常”、“正常”,故可知对于变异对(chr11-117860269-c-t, chr11-117864125-g-a)而言(即所述基因型组成的组合对是在两条同源染色体 的相同基因座上有两个突变等位基因的杂合基因型,复合杂合子上的杂合基因 与野生型等位基因一起组成一个复等位基因系列),先证者、先证者母亲、先 证者父亲的状况都符合孟德尔遗传规律。以前述本技术实施例例举的孟德尔遗 传一致性的获得方法,则mcs=1
×1×
1=1。
[0501]
取以上两种情况的最大mcs作为变异chr11-117860269-c-t的mcs,即 max(0.1,1)=1。
[0502]
因此,deps=vps
×
dss
×
mcs=0.5
×
0.25
×
1=0.125。
[0503]
因此,eps=max(deps)=0.125。
[0504]
这样,就获得到了本技术所述的变异解释(eps)。
[0505]
虽然本发明实施例披露如上,但本发明并非限定于此。任何本领域技术人 员,在不脱离本发明的精神和范围内,均可作各种更动与修改,因此本发明的 保护范围应当以权利要求所限定的范围为准。
当前第1页1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!