γ-j9九游会真人
:
1.本发明涉及医药生物技术领域,具体涉及一种γ-芳基丁烯内酯类化合物制备方法和在制备心血管保护药物中的应用。
背景技术:
2.γ-芳环丁烯内酯类化合物是指一类具有四碳杂环的内酯,且被3-苯基和4-苄基取代基的一类天然产物。从生境/来源来看,γ-丁烯内酯主要来源于海洋微生物、植物和动物样品中的内生真菌,以及从土壤中分离的环境真菌等。据统计,目前有176个γ-丁烯内酯被报道,其中106个化合物来自海洋微生物,占总比的54%。57个化合物来自植物内生真菌,占29%。对176个化合物的生物活性分析表明,其中68.2%(120个)的化合物表现出广泛的药理活性,包括抗氧化(32个)、抗病毒(30个)、抑制α-葡萄糖苷酶(28个)、抗菌(25个)、抗炎(13个)、抗肿瘤(12个)、细胞毒性(5个)、防污(5个)等。其余活性化合物表现出其他活性(9个化合物,占6%),如增强学习记忆活性和保护活性(3个化合物,占2.4%)等。
3.随着γ-丁烯内酯类新化合物的不断增加,此类结构的综述也有所报道。例如,joe和他的同事已经综述了海洋微生物中的丁烯内酯,但他们只关注了海洋被囊动物中三种类型的丁烯内酯(rubrolides,cadiolides和prunolides),chatterjee等回顾了2010-2022年γ-丁烯内酯类化合物的合成策略,主要集中在γ-丁烯内酯的合成,但对其天然产物分离研究、结构多样性及生物活性等方面的研究较少。天然产物相比于合成产物具有更显著的结构多样性及复杂性,同时在生物活性方面拥有更高的筛选率。
技术实现要素:
4.本发明的目的是提供一种γ-芳基丁烯内酯类化合物及其制备方法和在制备心血管保护药物中的应用。
5.本发明是通过以下技术方案予以实现的:
6.γ-芳基丁烯内酯类化合物,其结构式如下:
7.8.所述的γ-芳基丁烯内酯类化合物的制备方法,其特征在于,从海洋本草软珊瑚(sinulariasp.)共附生真菌aspergillus sp.egf7-0-1的发酵培养物中分离获得的。
9.具体包括以下步骤:
10.1)制备海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1的单培养基或共培养基;
11.2)将结合菌体的单培养基或共培养基分别用乙酸乙酯提取,然后浓缩提取液得到大米单培养乙酸乙酯浸膏或大米共培养乙酸乙酯浸膏;
12.3)将大米单培养乙酸乙酯浸膏用硅胶色谱层析进行分离,用v
pe
:v
etoac
=100:0
→
0:100的石油醚/乙酸乙酯进行洗脱,得到11个粗组分,fr.1~fr.11,将第5个粗组分fr.5用硅胶色谱层析进行分离,用v
ch2cl2
:v
meoh
=80:1~0:100的ch2cl2/meoh洗脱得到6个流分,fr.5-1~fr.5-6,fr.5-1经硅胶柱色谱用v
ch2cl2
:v
meoh
=80:1~0:100的ch2cl2/meoh洗脱得到3个流分,分别为fr.5-1-1~fr.5-1-3;fr.5-1-2用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到5个亚组分(fr.5-1-2-1~fr.5-1-2-5);以v
meoh
:v
h2o
=65:35为流动相,采用sp-hplc(流速:3ml/min)纯化第2亚组分fr.5-1-2-2,得到保留时间为16.5min的化合物f13、保留时间为23.0min的化合物f8、保留时间为36.5min的化合物f12和保留时间为45.4min的化合物f9;第4亚组分fr.5-1-2-4采用sp-hplc,以v
meoh
:v
h2o
=55:45为流动相纯化,得到保留时间为16.5min的化合物f2和保留时间为40.2min的化合物f1;第5个流分fr.5-5用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到四个亚组,fr.5-5-1~fr.5-1-4;以v
meoh
:v
h2o
=60:40为流动相,用sp-hplc纯化第1个亚组fr.5-5-1,得到保留时间为23.2min的化合物f10和保留时间为42.0min的化合物f11;
13.大米共培养乙酸乙酯浸膏经硅胶柱层析石油醚-乙酸乙酯体系洗脱(v
pe
:v
etoac
=100:0
→
0:100),根据薄层tlc情况合并得到11个粗组分fr.1~fr.11;fr.9经硅胶柱层析上用ch2cl
2-meoh(80:1~0:100)洗脱得到4个流分fr.5-1~fr.5-4);fr.5-1-2用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到5个亚组分,fr.5-1-2-1~fr.5-1-2-6;以v
meoh
:v
h2o
=70:30为流动相,采用sp-hplc纯化fr.5-1-2-3,得到保留时间为16.5min的化合物f3和保留时间为23.0min的化合物f4;fr.5-1-2-4采用sp-hplc以v
meoh
:v
h2o
=65:35为流动相纯化,得到保留时间为9.0min的化合物f7、保留时间为40.2min的化合物f5和保留时间为23.0min的化合物f6。
14.步骤1)制备海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1的单培养基或共培养基具体包括以下步骤:
15.a、将海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1接入装有pda培养基的培养瓶,28℃摇床培养,得到活化的种子培养液;
16.b、将活化的种子培养液接入装有大米培养基的培养瓶中单培养,或与保藏号为gdmccno.60476的aspergillus sp.egf15-0-3菌株共培养,28℃静置培养30天。
17.所述的大米培养基的配方为:100g大米、115ml水、盐度3.3%,ph自然。
18.pda培养基的配方:土豆200g、葡萄糖20g、琼脂15~20g、水1000ml、盐度3.5%、ph自然。
19.发明人首次从海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1的发酵培养物中分离获得上述结构新颖的γ-芳环丁烯内酯类化合物,并首次
发现上述化合物对心血管具有保护作用,为后续心血管疾病的研究提供药效物质基础。
20.因此本发明还保护上述γ-芳环丁烯内酯类化合物在制备心血管保护药物中的应用。
21.本发明的有益效果如下:发明人首次从海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1的发酵培养物中分离获得上述结构新颖的γ-芳环丁烯内酯类化合物,并首次发现上述化合物对心血管具有保护作用,为后续心血管疾病的研究提供药效物质基础。
22.本发明的海洋本草软珊瑚(sinularia sp.)共附生真菌aspergillus sp.egf7-0-1已公开于樊浩,何嘉鸿,韦霞,陈乐怡,陈欣琪,张翠仙,海洋本草软珊瑚共附生真菌aspergillus sp.egf7-0-1中酚酸类化学成分研究(ⅱ)(即该文献中的海洋本草软珊瑚共附生真菌aspergillussp.egf7-0-1)。该菌株本技术人也持有,并保证自申请日起20年内向公众提供。
23.本发明的保藏号为gdmcc no.60476的aspergillus sp.egf15-0-3菌株采集于中国南海三亚海域的软珊瑚分离而来,种属鉴定为曲霉属(aspergillus)真菌,已公开于cn109439705b,一种柳珊瑚酸的微生物制备方法。
附图说明:
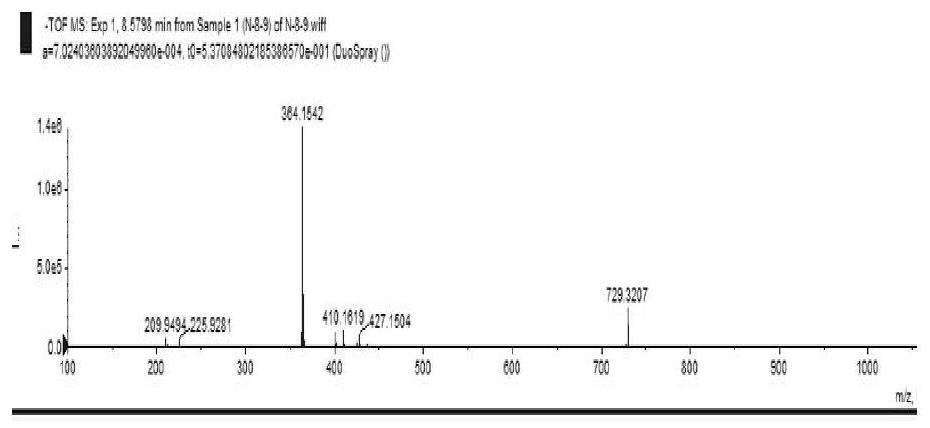
24.图1是化合物f1的hresims质谱图;
25.图2是化合物f1的ir图;
26.图3是化合物f1的1h nmr谱图(400mhz,cd3od);
27.图4是化合物f1的
13
c nmr谱图(100mhz,cd3od);
28.图5是化合物f1的dept 135(100mhz,cd3od)谱图;
29.图6是化合物f1的1h-1
h cosy谱图;
30.图7是化合物f1的hsqc谱图;
31.图8是化合物f1的hmbc谱图;
32.图9是化合物f1的noesy谱图;
33.图10是化合物f1和f2的1h-1
h-cosy、关键hmbc和noe相关示意图;
34.图11是化合物f1实测和计算ecd谱图(左)及单晶x-衍射结构图(右);
35.图12是化合物f2的hresims质谱图;
36.图13是化合物f2的ir图;
37.图14是化合物f2的1h nmr谱图(400mhz,cd3od);
38.图15是化合物f2的
13
c nmr谱图(100mhz,cd3od);
39.图16是化合物f2的dept 135(100mhz,cd3od)谱图;
40.图17是化合物f2的1h-1
h cosy谱图;
41.图18是化合物f2的hsqc谱图;
42.图19是化合物f2的hmbc谱图;
43.图20是化合物f3和f4的1h-1
h-cosy、关键hmbc相关示意图;
44.图21化合物f3的hresims谱图;
45.图22是化合物f3的ir图;
46.图23是化合物f3的1h nmr谱图(400mhz,cd3od);
47.图24是化合物f3的
13
c nmr谱图(100mhz,cd3od);
48.图25是化合物f3的dept 135(100mhz,cd3od)谱图;
49.图26是化合物f3的1h-1
h cosy谱图;
50.图27是化合物f3的hsqc谱图;
51.图28是化合物f3的hmbc谱图;
52.图29是化合物f3的单晶x-衍射结构图;
53.图30是化合物f4的单晶x-衍射结构图;
54.图31化合物f4的hresims谱图;
55.图32是化合物f4的ir图;
56.图33是化合物f4的1h nmr谱图(400mhz,cd3od);
57.图34是化合物f4的
13
c nmr谱图(100mhz,cd3od);
58.图35是化合物f4的dept 135(100mhz,cd3od)谱图;
59.图36是化合物f4的1h-1
h cosy谱图;
60.图37是化合物f4的hsqc谱图;
61.图38是化合物f4的hmbc谱图;
62.图39是化合物f5和f6的1h-1
h-cosy、关键hmbc相关示意图;
63.图40是化合物f5-f6的实测和计算ecd谱图;
64.图41化合物f5的hresims谱图;
65.图42是化合物f5的ir图;
66.图43是化合物f5的1h nmr谱图(400mhz,cd3od);
67.图44是化合物f5的
13
c nmr谱图(100mhz,cd3od);
68.图45是化合物f5的dept 135(100mhz,cd3od)谱图;
69.图46是化合物f5的1h-1
h cosy谱图;
70.图47是化合物f5的hsqc谱图;
71.图48是化合物f5的hmbc谱图;
72.图49化合物f6的hresims谱图;
73.图50是化合物f6的ir图;
74.图51是化合物f6的1h nmr谱图(400mhz,cd3od);
75.图52是化合物f6的
13
c nmr谱图(100mhz,cd3od);
76.图53是化合物f6的dept 135(100mhz,cd3od)谱图;
77.图54是化合物f6的1h-1
h cosy谱图;
78.图55是化合物f6的hsqc谱图;
79.图56是化合物f6的hmbc谱图;
80.图57是化合物f7、f8和f9的1h-1
h-cosy、关键hmbc相关示意图;
81.图58是化合物f7-f9的实测和计算ecd谱图;
82.图59化合物f7的hresims谱图;
83.图60是化合物f7的ir图;
84.图61是化合物f7的1h nmr谱图(400mhz,cd3od);
85.图62是化合物f7的
13
c nmr谱图(100mhz,cd3od);
86.图63是化合物f7的dept 135(100mhz,cd3od)谱图;
87.图64是化合物f7的1h-1
h cosy谱图;
88.图65是化合物f7的hsqc谱图;
89.图66是化合物f7的hmbc谱图;
90.图67化合物f8的hresims谱图;
91.图68是化合物f8的ir图;
92.图69是化合物f8的1h nmr谱图(400mhz,cd3od);
93.图70是化合物f8的
13
c nmr谱图(100mhz,cd3od);
94.图71是化合物f8的dept 135(100mhz,cd3od)谱图;
95.图72是化合物f8的1h-1
h cosy谱图;
96.图73是化合物f8的hsqc谱图;
97.图74是化合物f8的hmbc谱图;
98.图75化合物f9的hresims谱图;
99.图76是化合物f9的ir图;
100.图77是化合物f9的1h nmr谱图(400mhz,cd3od);
101.图78是化合物f9的
13
c nmr谱图(100mhz,cd3od);
102.图79是化合物f9的dept 135(100mhz,cd3od)谱图;
103.图80是化合物f9的1h-1
h cosy谱图。
具体实施方式:
104.以下是对本发明的进一步说明,而不是对本发明的限制。
105.实施例1:γ-芳基丁烯内酯类化合物的制备
106.一、微生物发酵
107.培养基组成:大米培养基:100g大米、115ml水、盐度3.3%,ph自然。
108.pda培养基:土豆200g、葡萄糖20g、琼脂20g、水1000ml、盐度3.5%、ph自然。
109.菌种活化:用接种环从菌种管中挑取海洋本草软珊瑚共附生真菌aspergillus sp.egf7-0-1菌种到装有pda培养基的培养瓶中(400ml/1000ml),将其放置于28℃的恒温摇床(165r/min)中培养2天,获得种子液。
110.接种:吸取已活化的种子培养液10ml至装有400ml大米培养基的1l培养瓶中单培养200l得到单培养基,吸取已活化的种子培养液10ml与egf15-0-3菌株至装有400ml大米培养基的1l培养瓶中共培养400l。将上述培养基置于28℃的室内静置培养30天。
111.二、γ-芳环丁烯内酯类化合物的分离:
112.提取:aspergillus sp.egf7-0-1大米单培养及共培养菌株培养结束后,向培养瓶中各加入250ml etoac,并至于摇床上,165r/min振摇提取3次(8h/次),过滤、合并etoac浸提液,经过减压浓缩后分别获得大米单培养乙酸乙酯浸膏(500.0g)及大米共培养乙酸乙酯浸膏(1250.0g)。
113.分离:200l大米培养基共获得大米单培养乙酸乙酯浸膏(500.0g)经硅胶柱层析(φ=12.5cm、l=110cm、装柱硅胶2.3kg(高度57cm)、柱体积3.85l)石油醚-乙酸乙酯体系
洗脱(v
pe
:v
etoac
=100:0
→
0:100、1l/瓶),根据薄层tlc情况合并得到11个粗组分fr.1~fr.11。fr.5(200.0g)经硅胶柱层析上用ch2cl
2-meoh(80:1~0:100)洗脱得到6个流分(fr.5-1~fr.5-6)。fr.5-1经硅胶柱色谱用v
ch2cl2
:v
meoh
=80:1~0:100的ch2cl2/meoh洗脱得到3个流分,分别为fr.5-1-1~fr.5-1-3。fr.5-1-2(3.0g)用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到5个亚组分(fr.5-1-2-1~fr.5-1-2-5)。以v
meoh
:v
h2o
=65:35为流动相,采用sp-hplc(流速:3ml/min)纯化fr.5-1-2-2(1.2g),得到保留时间为16.5min的化合物f13为12.6mg、f8(tr=23.0min、15.5mg)、保留时间为36.5min的化合物f12为10.2mg和保留时间为45.4min的化合物f9为12.2mg。fr.5-1-2-4(2.0g)采用sp-hplc(流速:3ml/min),以v
meoh
:v
h2o
=55:45为流动相纯化,得到保留时间为16.5min的化合物f2为2.5mg和保留时间为40.2min的化合物f1为4.0mg。fr.5-5(1.5g)用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到四个亚组(fr.5-5-1~fr.5-1-4)。以v
meoh
:v
h2o
=60:40为流动相,用sp-hplc(流速:3ml/min)纯化fr.5-5-1(0.4g),得到保留时间为23.2min的化合物f10为8.0mg和保留时间为42.0min的化合物f11为25.8mg。
114.大米共培养乙酸乙酯浸膏(1250.0g)经硅胶柱层析石油醚-乙酸乙酯体系洗脱(v
pe
:v
etoac
=100:0
→
0:100、1l/瓶),根据薄层tlc情况合并得到11个粗组分fr.1~fr.11。fr.9(10.0g)经硅胶柱层析上用ch2cl
2-meoh(80:1~0:100)洗脱得到4个流分(fr.5-1~fr.5-4)。fr.5-1-2(5.0g)用sephadex lh-20凝胶柱层析分离,用甲醇洗脱得到5个亚组分(fr.5-1-2-1~fr.5-1-2-6)。以v
meoh
:v
h2o
=70:30为流动相,采用sp-hplc(流速:3ml/min)纯化fr.5-1-2-3(0.3g),得到保留时间为16.5min的化合物f3为15.6mg和保留时间为23.0min的化合物f4为12.3mg。fr.5-1-2-4(2.0g)采用sp-hplc(流速:2ml/min),以
meoh
:v
h2o
=65:35为流动相纯化,得到保留时间为9.0min的化合物f7为3.0mg、保留时间为40.2min的化合物f5为30.5mg和保留时间为23.0min的化合物f6为15.5mg。
115.结构式如下:
[0116][0117]
三、γ-芳环丁烯内酯类化合物结构鉴定:
[0118]
采用nmr、ms、uv、cd/ecd、xrd、ord等技术对所分离得到的化合物进行结构鉴定。
[0119]
aspergteroid g(化合物f1)为无色晶体(meoh),其结构鉴定如下:
[0120]
如图1-9所示,图1是化合物f1的hresims质谱图;图2是化合物f1的ir图;图3是化合物f1的1h nmr谱图;图4是化合物f1的
13
c nmr谱图;图5是化合物f1的dept 135(100mhz,
cd3od)谱图;图6是化合物f1的1h-1
h cosy谱图;图7是化合物f1的hsqc谱图;图8是化合物f1的hmbc谱图;图9是化合物f1的noesy谱图。
[0121]
参见图1hresims给出准分子离子峰m/z:364.1542[m-h]-(计算值:364.1549),确定其分子式为c
22h23
no4,不饱和度为12。[α]
25d
64.6(c 0.10,meoh);uv(meoh)λ
max
(logε):229(3.69),278(3.08);ir
(neat)νmax
:3292,1705,1515,1496cm-1
;1h nmr谱图显示存在一组对取代苯酚(a2b2体系)δ
h 7.58(d,8.8hz,2h)和6.87(d,8.8hz,2h),三个芳环质子氢信号信号δ
h 6.83(s,1h)、6.58(d,8.2hz,1h)和6.85(d,8.2hz,1h),提示存在一个额外不对称三取代苯环。
13
c nmr谱显示22个分辨良好的共振峰,其中两个羰基碳δc181.3(c)和181.7(c)和两个甲基δ
c 53.2(ch)和53.6(ch)是马来酰亚胺结构的特征。10个芳环质子信号归属于芳环,三个亚甲基信号δ
c 23.3(ch2),33.8(ch2)和35.6(ch2)和一个连氧季碳δ
c 75.2(c)。
[0122]
进一步解析二维谱图图7(hsqc、表1),在1h-1
h-cosy谱图(图6)中h-3(δ
h 3.64,d,5.7)/h-4(δ
h 3.16,m);h-2'(6')(δ
h 6.76,d,8.6)/h-3'(5')(δ
h 6.63,d,8.6)h-5”(δ
h 6.58,d,8.2)/h-6”(δ
h 6.85,d,8.2)及h-7”(δ
h 2.66,m)/h-8”(δ
h 1.76,t,6.8)。以及图8的hmbc谱中h-3(δ
h 3.64,d,5.7)/c-2(δ
c 181.2,c),c-5(δ
c 181.7,c)及c-1'(δ
c 129.7,c);h-4(δ
h 3.16,m)/c-2(δ
c 181.3,c),c-5(δ
c 181.7,c),及c-1”(δ
c 129.7,c);h
a-6(δ
h 2.88,dd,13.8,8.5)及h
b-6(δ
h 3.13,m)/c-3(δc53.2,ch),c-4(δ
c 53.6,ch),c-5(δ
c 181.7,c),c-1”(δ
c 129.7,c),c-2”(δ
c 131.4,c)及c-6”(δ
c 129.3,c);h-7”(δ
h 2.66,m)/c-2”(δ
c 131.4,c),c-3”(δ
c 123.3,c),c-4”(δ
c 154.1,c)及c-9”(δ
c 75.2,c);h-8”(δ
h 1.76,t,6.8)/c-3”(δ
c 123.3,c),c-9”(δ
c 75.2,c)及c-10”(δ
c 26.9,c);h-11”(δ
h 1.28,s)/c-9”(δ
c 75.2,c)及c-10”(δ
c 26.9,c)从而确定化合物f1的平面结构(见图5)。
[0123]
根据图9中noesy谱图h-3(δ
h 3.64,d,5.7)和h-6(δ
h h-6a:2.88,dd,13.8,8.5;h-6b:3.13,m)的相关性,提示h-3和h-6a、h-6b质子共面。化合物f1绝对构型通过单晶x射线衍射实验和量子化学ecd计算确定,flack参数为0.02(11),确定f1的绝对构型确定为3s,4r。(图11)。
[0124]
表1.化合物f1-f2的1hnmr和
13
c nmr核磁数据(δinppm,jin hz,溶剂甲醇)
[0125][0126]
aspergteroid h(化合物f2)淡黄色油胶状(meoh),uv(meoh)λ
max
(logε):224(3.95),276(2.76);ir
(neat)νmax
:3321,1705,1514,1240cm-1
;图12是化合物f2的hresims质谱图;
[0127]
图13是化合物f2的ir图;图14是化合物f2的1h nmr谱图(400mhz,cd3od);图15是化合物f2的
13
c nmr谱图(100mhz,cd3od);图16是化合物f2的dept 135(100mhz,cd3od)谱图;图17是化合物f2的1h-1
h cosy谱图;图18是化合物f2的hsqc谱图;图19是化合物f2的hmbc谱图。
[0128]
hresims给出的准分子离子峰m/z:294.0768[m-h]-(计算值:294.0766),确定其分子式为c
17h13
no4,不饱和度为11。
[0129]
对比nmr数据发现,化合物f2和化合物f1的nmr数据极为相似(见表1),提示它们可能存在相同的结构片段。与化合物f1相比,化合物f2在δ
h 6.99(d,8.6hz,2h)和6.83(d,8.6hz,2h)处增加了一个对取代苯酚(a2b2体系)和两个烯烃碳键δ
c 139.7(c)和138.2(c)的信号,而在化合物f2中缺失三个亚甲基信号δ
c 23.3(ch2),33.8(ch2)和35.6(ch2)和一个连氧季碳δ
c 75.2(c)。1h-1h-cosy谱图(图17)中h-2'(6
′
)(δh6.76,d,8.6)/h-3
′
(5
′
)(δ
h 6.63,d,8.6)、h-2
″
(6
″
)(δ
h 6.99,d,8.6)/h-3
″
(4
″
)(δ
h 6.83,d,8.6),结合hmbc谱图(图19)相关信号h-6(δ
h 2.80,s)/c-3(δ
c 139.7,c),c-4(δ
c 138.2,c),c-5(δ
c 174.0,c),c-1”(δ
c 129.8,c),及c-2”(6”)(δc130.3,c),从而确定化合物f2的平面结构(图10和表1)。
[0130]
aspergteroid i(化合物f3)无色晶体(meoh),[α]
25d
38.7;uv(meoh)λ
max
(logε):224(3.95),280(2.80);ir
(neat)νmax
:3342,1681,1508,1257cm-1
,图21化合物f3的hresims谱图;
[0131]
图22是化合物f3的ir图;图23是化合物f3的1h nmr谱图(400mhz,cd3od);图24是化
合物f3的
13
c nmr谱图(100mhz,cd3od);图25是化合物f3的dept 135(100mhz,cd3od)谱图;图26是化合物f3的1h-1
h cosy谱图;图27是化合物f3的hsqc谱图;图28是化合物f3的hmbc谱图;图29是化合物f3的单晶x-衍射结构图。
[0132]
hresims谱图(图21)给出的准分子离子峰m/z:368.1500[m-h]-(计算值:368.1498),确定其分子式为c
21h23
no5,不饱和度为11。1h nmr谱图(图23)显示存在一组对取代苯酚(a2b2体系)δ
h 8.09(d,8.9hz,2h)和6.78(d,8.9hz,2h),三个芳环质子氢信号信号δh6.85(d,2.0hz,1h)、6.61(d,8.0hz,1h)和6.83(dd,8.0,2.0hz,1h),提示存在一个额外不对称三取代苯环。
13
c nmr谱显示21个分辨良好的共振峰,其中一个孤立羰基碳δ
c 196.7(c)和一个为酰胺基碳信号176.4(c)。一个含三取代双键的异戊烯基δ
c 28.5(ch2)、123.1(ch)、133.0(c)、25.9(ch3)、17.7(ch3)和两个亚甲基信号δc42.9(ch2)和29.2(ch2)。
[0133]
进一步解析图27二维谱图(hsqc)(见表2),在1h-1
h-cosy谱图(图26)中h-2'(6')(δ
h 8.09,d,8.9)/h-3'(5')(δ
h 6.78,d,8.9);h-5”(δ
h 6.61,d,8.0)/h-6”(δh6.85,dd,8.0,2.0);h-7”(δ
h 3.22,d,7.3)/h-8”(δ
h 5.25,t,7.3)。以及图28hmbc谱中h-4a(δ
h 3.19,d,15.0),h-4b(δ
h 3.29,d,15.0)/c-2(δ
c 196.7,c)、c-2(δ
c 84.6,c)、c-1”(δ
c 127.7,c);h-7”(δ
h 3.22,d,7.3)/c-2”(δ
c 132.8,c),c-3”(δ
c 127.6,c),c-4”(δ
c 154.9,c)及c-9”(δ
c 132.7,c);h-8”(δ
h 5.25,t,7.3)/c-3”(δ
c 127.6,c),c-9”(δ
c 132.7,c)及c-10”(δ
c 17.8,c);h-11”(δ
h 1.67,s)/c-9”(δ
c 132.7,c)及c-10”(δ
c 17.8,c)从而确定化合物f3的平面结构(见图20)。化合物f3绝对构型通过单晶x射线衍射实验确定,flack参数为0.04(8),确定f3的绝对构型确定为3r。(图29)。
[0134]
表2.化合物f3-f4的1h nmr和
13
c nmr核磁数据(δinppm,jin hz,溶剂甲醇)
[0135][0136]
aspergteroid j(化合物f4)无色晶体(meoh),[α]
25d
33.8;uv(meoh)λ
max
(logε):
224(3.95),280(2.80);ir
(neat)νmax
:3363,1716,1558,1261cm-1
,图30是化合物f4的单晶x-衍射结构图,图31化合物f4的hresims谱图;图32是化合物f4的ir图;图33是化合物f4的1hnmr谱图(400mhz,cd3od);图34是化合物f4的
13
c nmr谱图(100mhz,cd3od);图35是化合物f4的dept 135(100mhz,cd3od)谱图;图36是化合物f4的1h-1
h cosy谱图;图37是化合物f4的hsqc谱图;图38是化合物f4的hmbc谱图;
[0137]
图31中hresims给出的准分子离子峰m/z:368.1500[m-h]-(计算值:368.1498),确定其分子式为c
21h23
no5,不饱和度为11。化合物f4和化合物f3的nmr数据极为相似(见表1),提示它们可能存在相同的结构片段。在
13
c nmr和dept谱图中,与f3相比f4缺失一个烯烃质子信号δ
h 5.25,t,7.3及两个烯烃碳信号δ
c 123.1(ch)、133.0(c),与f3中两个亚甲基和一个连氧sp3碳相比,f4中存在三个亚甲基和两个连氧sp3季碳。数据表明,二氢吡喃环与三取代苯环骈合,取代了f3中链状戊烯基,并结合图361h-1
h cosy的关键相关信号h-7”(δ
h 2.71,t,6.6)/h-8”(δ
h 2.71,t,6.6)以及图38hmbc谱图相关h-7”(δ
h 2.71,t,6.6)/c-2”(δ
c 132.7,ch),c-3”(δ
c 121.4,c),c-4”(δ
c 154.0,c),c-8”(δ
c 33.9,ch2)及c-9”(δ
c 75.0,c);h-8”(δ
h 2.71,t,6.6)/c-3”(δ
c 121.4,c),c-7”(δ
c 23.4,ch2),c-9”(δ
c 75.0,c)及c-10”(δ
c 27.1,ch3)建立了通过苯环的c3
”‑
c4”键骈合的二氢吡喃环。化合物f4绝对构型通过单晶x射线衍射实验确定,flack参数为-0.2(2),确定f4的绝对构型确定为3r。(图30)。
[0138]
表3.化合物f5-f6的1hnmr和
13
c nmr核磁数据(δinppm,jin hz,溶剂甲醇)
[0139][0140]
aspergteroid k(化合物f5)淡黄色油胶状,(meoh),[α]
25d
60.9;uv(meoh)λ
max
(logε):224(3.95),306(4.43);ir
(neat)νmax
:1238,1004,812cm-1
。
[0141]
图41是化合物f5的hresims谱图;图42是化合物f5的ir图;图43是化合物f5的1hnmr谱图(400mhz,cd3od);图44是化合物f5的
13
c nmr谱图(100mhz,cd3od);图45是化合物f5的dept 135(100mhz,cd3od)谱图;图46是化合物f5的1h-1
h cosy谱图;图47是化合物f5的hsqc谱图;图48是化合物f5的hmbc谱图;图39是化合物f5和f6的1h-1
h-cosy、关键hmbc相关示意图;图40是化合物f5-f6的实测和计算ecd谱图。
[0142]
图41中hresims给出的准分子离子峰m/z:408.1449[m-h]-(计算值:408.1447),确定其分子式为c
23h23
no6,不饱和度为13。1h nmr谱图显示存在一组对取代苯酚(a2b2体系)δ
h 7.80(d,8.8hz,2h)和6.85(d,8.8hz,2h),三个芳环质子氢信号信号δh6.50(s,2.0hz,1h)、6.44(d,8.0hz,1h)和6.55(dd,8.0,2.0hz,1h),提示存在一个额外不对称三取代苯环。
13
c nmr谱显示25个分辨良好的共振峰,其中一个全取代五元α,β不饱和内酯环δ
c 170.4(c)、139.6(c)、130.0(c)、87.9(c)、一个为酰胺基碳信号174.0(c)、一个含三取代双键的异戊烯基δ
c 28.7(ch2)、123.6(ch)、132.9(c)、25.9(ch3)、17.8(ch3)和两个亚甲基信号δc42.9(ch2)和29.2(ch2)。
[0143]
进一步解析图47二维谱图(hsqc)(见表3),在1h-1
h-cosy谱图(图46)中h-2'(6')(δ
h 7.80,d,8.8)/h-3'(5')(δ
h 6.78,d,8.8);h-5”(δ
h 6.44,d,8.5)/h-6”(δh6.55,dd,8.5,2.0);h-7”(δ
h 3.09,m)/h-8”(δ
h 5.08,t,6.5)。以及图48hmbc谱中h-4a(δ
h 3.38,d,15.0),h-4b(δ
h 3.41,d,15.0)/c-2(δ
c 170.4,c)、c-1”(δ
c 125.6,c);h-7”(δ
h 3.09,m)/c-2”(δ
c 132.5,c),c-3”(δ
c 128.4,c),c-4”(δ
c 154.9,c)及c-9”(δ
c 132.9,c);h-8”(δ
h 5.08,t,6.5)/c-3”(δ
c 128.4,c),c-9”(δ
c 132.9,c)及c-10”(δ
c 25.9,c);h-11”(δ
h 1.67,s)/c-9”(δ
c 132.9,c)及c-10”(δ
c 25.9,c)从而确定化合物f5的平面结构(见图39)。
[0144]
同样,根据生源途径和量子化学ecd计算(图40)。确定化合物f5的绝对构型为5r。
[0145]
aspergteroid l(化合物f6)淡黄色油胶状(meoh),,[α]
25d
68.5;uv(meoh)λ
max
(logε):224(3.95),276(2.76);ir
(neat)νmax
:3334,1749,1683,1259cm-1
。
[0146]
图49是化合物f6的hresims谱图;图50是化合物f6的ir图;图51是化合物f6的1hnmr谱图(400mhz,cd3od);图52是化合物f6的
13
c nmr谱图(100mhz,cd3od);图53是化合物f6的dept 135(100mhz,cd3od)谱图;图54是化合物f6的1h-1
h cosy谱图;图55是化合物f6的hsqc谱图;图56是化合物f6的hmbc谱图。
[0147]
图49中hresims给出的准分子离子峰m/z:408.1449[m-h]-(计算值:408.1447),确定其分子式为c
23h23
no6,不饱和度为13。化合物f6和化合物f5的nmr数据极为相似(见表3),提示它们可能存在相同的结构片段。在图52中
13
c nmr和图53中dept谱图中,与f6相比f5缺失一个烯烃质子信号δ
h 5.08(t,6.5)及两个烯烃碳信号δ
c 123.6(ch)、132.9(c),与f5中两个亚甲基和一个连氧sp3碳相比,f6中存在三个亚甲基和两个连氧sp3季碳。数据表明,二氢吡喃环与三取代苯环骈合,取代了f5中独立的戊烯基链,并结合1h-1
hcosy的关键相关信号h-7”(δ
h 2.71,t,6.6)/h-8”(δ
h 2.71,t,6.6)以及hmbc谱图相关h-7”(δ
h 2.57,m)/c-2”(δ
c 132.7,ch),c-3”(δ
c 126.0,c),c-4”(δ
c 154.2,c),c-8”(δ
c 33.7,ch2)及c-9”(δ
c 75.1,c);h-8”(δ
h 1.71,t,6.5)/c-3”(δ
c 126.0,c),c-7”(δ
c 23.2,ch2),c-9”(δ
c 75.1,c)及c-10”(δ
c 27.0,ch3)建立了通过苯环的c3
”‑
c4”键骈合的二氢吡喃环。
[0148]
根据生源途径和量子化学ecd计算(图40)。确定化合物f6的绝对构型为5r。
[0149]
aspergteroidm(化合物f7)淡黄色油胶状(meoh),[α]
25d
61.2;uv(meoh)λ
max
(logε):226(4.15),306(4.43);ir
(neat)νmax
:3338,1745,1683,1516cm-1
。
[0150]
图59是化合物f7的hresims谱图;图60是化合物f7的ir图;图61是化合物f7的1hnmr谱图(400mhz,cd3od);图62是化合物f7的
13
c nmr谱图(100mhz,cd3od);图63是化合物f7的dept 135(100mhz,cd3od)谱图;图64是化合物f7的1h-1
h cosy谱图;图65是化合物f7的hsqc谱图;图66是化合物f7的hmbc谱图。
[0151]
图59中hresims给出的准分子离子峰m/z:340.0834[m-h]-(计算值:340.0821),确定其分子式为c
18h15
no6,不饱和度为12。将化合物f7的nmr数据与化合物f5对比,发现二者十分相似。化合物f7的nmr显示其含有两个对位取代的芳基:[δ
h 6.66d 8.8hz 2h,h-2'/6'、6.85d 8.8hz 2h,h-3'/5';δ
c 132.6(ch)、116.3(ch)、δ
h 7.80d 8.8hz 2h,h-2”/6”、6.52d 8.8hz 2h,h-3”/5”;δ
c 130.9(ch)、115.5(ch)],而无异戊烯基信息δ
c 28.7(ch2)、123.6(ch)、132.9(c)、25.9(ch3)、17.8(ch3)。1h-1
h-cosy谱图(图64)中h-2'(6
′
)(δ
h 6.66d 8.8)/h-3'(4')(δh6.85 d 8.8)h-2”(6”)(δ
h 6.66,d,8.8)/h-3”(5”)(δ
h 6.52,d,8.8),结合hmbc谱图相关信号h-6(δ
h 3.41,s)/c-3(δ
c 139.7,c),c-4(δ
c 129.2,c),c-5(δ
c 87.9,c),c-1”(δ
c 131.2,c),及c-2”(6”)(δ
c 132.6,c),从而确定化合物f7的平面结构(图57和表4)。根据生源途径和量子化学ecd计算(图58)。确定化合物f7的绝对构型为5r。
[0152]
表4.化合物f7-f9的1hnmr和
13
c nmr核磁数据(δinppm,jin hz,溶剂甲醇)
[0153][0154][0155]
aspergteroidn(化合物f8)淡黄色油胶状,[α]
25d
65.8(c 0.10,meoh);uv(meoh)λ
max
(logε):230(3.40),306(4.43)nm;ir
(neat)νmax
:3336,1734,1519,1255cm-1
;
[0156]
图67是化合物f8的hresims谱图;图68是化合物f8的ir图;图69是化合物f8的1hnmr谱图(400mhz,cd3od);图70是化合物f8的
13
c nmr谱图(100mhz,cd3od);图71是化合物f8的dept 135(100mhz,cd3od)谱图;图72是化合物f8的1h-1
h cosy谱图;图73是化合物f8的hsqc谱图;图74是化合物f8的hmbc谱图。
[0157]
图67中hresims给出的准分子离子峰m/z:437.1602[m-h]-(计算值:437.1600),确定其分子式为c
25h27
o7,不饱和度为13。化合物f8和化合物f6的nmr数据极为相似,只是未见
含氮信息,而增加了乙基信息[δh4.25,q,7.0hz,h-8;δ
h 1.21,t,7.0hz,h-9;δ
c 63.6(ch2)δ
c 14.3(ch3)],提示它们可能存在相同骨架信息。同时hmbc重显示δh4.25(q,7.0)与δ
c 171.1(c-7)相关,确定其平面结构(图57)
[0158]
同样,根据生源途径和量子化学ecd计算(图58)。确定化合物f8的绝对构型为5r。
[0159]
aspergteroid o(化合物f9)淡黄色油胶状,[α]25d 83.5(c 0.10,meoh);uv(meoh)λ
max
(logε):226(4.15),306(4.33),320(3.02)nm;ir
(neat)νmax
:3307,1739,1498,1257cm-1
;
[0160]
图75是化合物f9的hresims谱图;图76是化合物f9的ir图;图77是化合物f9的1hnmr谱图(400mhz,cd3od);图78是化合物f9的
13
c nmr谱图(100mhz,cd3od);图79是化合物f9的dept 135(100mhz,cd3od)谱图;图80是化合物f9的1h-1
h cosy谱图。
[0161]
图75中hresims给出的准分子离子峰m/z:407.1493[m-h]-(计算值:407.1495),确定其分子式为c
24h24
o6,不饱和度为13。对化合物f9和化合物f8的1d nmr谱进行综合分析表明,其nmr基本相似,只是减少了一个亚甲基信息[δh4.25,q(7.0)与δc63.6(ch2)];同时观察hmbc,发现δh3.49(s,1h,h-8)与δ
c 171.3(c-7)相关,确定其平面结构(图57)。
[0162]
同样,基于生源途径和量子化学ecd计算(图58),确定f9的绝对构型为5r。
[0163]
化合物f1晶体学数据:c
22h23
no4(m=365.41g/mol):斜方晶系,空间群p212121(no.19),z=4,t=173.00(10)k,μ(cu kα)=0.719mm-1
,dcalc=1.290g/cm3,17318reflections measured(4.934
°
≤2θ≤147.694
°
),3749unique(r
int
=0.0508,r
sigma
=0.0449)。the final r
1 was 0.0514(i》2σ(i))and wr
2 was 0.1072.flackparameter 0.02(11).化合物f1的晶体学数据已存放在剑桥晶体学数据中心(编号:ccdc 2262868)。
[0164]
化合物f3晶体学数据:c
21h27
no7(m=405.43g/mol):斜方晶系,空间群p212121(no.19),z=4,t=170.1(2)k,μ(cu kα)=0.810mm-1
,dcalc=1.297g/cm3,14163reflections measured(6.68
°
≤2θ≤147.976
°
),4145unique(r
int
=0.0295,r
sigma
=0.0239)。the final r
1 was 0.0766(i》2σ(i))and wr
2 was 0.2145.flack parameter 0.04(8).化合物f3的晶体学数据已存放在剑桥晶体学数据中心(编号:ccdc 2267460)。
[0165]
化合物f4晶体学数据:c
21h23
no5(m=369.40g/mol):单斜晶系,空间群p21(no.4),β=97.254(4)
°
,z=2,t=169.99(10)k,μ(cu kα)=0.694mm-1
,dcalc=1.183g/cm3,4255reflections measured(3.998
°
≤2θ≤148.31
°
),3844unique(r
int
=0.1226,r
sigma
=0.0806)the final r
1 was 0.1516(i》2σ(i))and wr
2 was 0.3945.flackparameter-0.2(2).化合物f4的晶体学数据已存放在剑桥晶体学数据中心(编号:ccdc 2267462)。
[0166]
实施例2:γ-芳环丁烯内酯类化合物在制备心血管保护药物中的应用
[0167]
一、细胞活性评价
[0168]
采用细胞计数试剂盒(cck-8)检测化合物f1-f13对h9c2心肌细胞株的细胞毒性。将各给药组与空白组在37℃作用48小时的细胞活力进行比较(p<0.05)。结果表明,化合物f1-f13在0,0.1,1,10μm浓度下不表现出明显的细胞毒作用。
[0169]
二、心血管保护作用评价
[0170]
评估了化合物f1-f13对tbhp(叔丁基过氧化氢)诱导的h9c2细胞凋亡的保护作用。根据细胞存活率估计细胞损伤。结果表明,tbhp显著降低了细胞存活率(p《0.05)。其中化合物f1-f7和f9-f11在低浓度下具有保护作用,与模型组相比保护率为f1:14.01%、f2:0.36%、f8:1.05%、f9:0.27%,f6和f10与阳性药二氮嗪相比保护率分别提高为19.3%和27.2%。而化合物f8,f9,f12和f13在这三种低浓度下(0.1、1和10μm)均不能提高细胞活力,提示γ-丁烯内酯类化合物的心脏保护作用可能与其苯基和苯基双取代类型和氮元素有关。
[0171]
基于心肌保护作用评价结果及化学结构的相似度,为探索f1的可能的心脏保护作用机制,利用swiss target prediction数据库预测了f1和f2的前100个潜在机制基因,并从venn图中得到24个重叠基因。利用string 11.5数据库和cytoscape 3.9.0软件建立蛋白-蛋白相互作用(protein-protein interaction,ppi)网络,筛选关键靶点以及网络分析中表示度分数的符号的大小和颜色。ppi分析结果显示,糖原合成酶激酶-3β(gsk-3β)的度评分最高,说明gsk-3β可能是f1的必需蛋白。
[0172]
我们发现,在tbhp诱导的心肌细胞氧化应激损伤后,f1可以抑制gsk-3β活性,下调nlrp3炎症体的激活,减轻炎症反应。bcl-2/bax和caspase 3的表达变化表明,化合物f1能够有效抑制细胞凋亡,保护心肌细胞。
[0173]
化合物f1对低浓度tbhp诱导的h9c2细胞凋亡具有保护作用。我们进一步试图通过网络药理学和tbph诱导心肌细胞氧化应激损伤模型探讨其可能的机制,结果表明,化合物f1可能通过gsk-3β/nlrp3通路减轻炎症反应,保护心肌细胞。同时,调控caspase 3和bax的表达,上调抗凋亡基因bcl-2,提高细胞抗氧化能力,抑制细胞凋亡。
当前第1页1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!